
| A. | 16O和18O原子的核外电子排布不相同 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
分析 A.原子核外电子排布与质子数有关;
B.含有离子键的化合物一定由阴阳离子构成;
C.HF中存在氢键;
D.干冰为分子晶体,二氧化硅为原子晶体.
解答 解:A.两种核素均为氧元素的不同种原子,核电荷数为8,核外电子排布方式相同,故A错误;
B.离子化合物是含有离子键的化合物,所以含有离子键的化合物一定是离子化合物,故B正确;
C.HF中存在氢键,故HF的熔沸点反常的升高,比HCl、HBr、HI的熔沸点均高,故C错误;
D.干冰为分子晶体,熔化时克服分子间作用力,二氧化硅为原子晶体,熔化时克服共价键,故D错误;故选B.
点评 本题考查知识点较多,熟悉化学键、原子核外电子排布和氢键对物质熔沸点的影响,难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | I2具有还原性 | ||
| C. | 当生成1mol Cl2时转移2mol电子 | D. | 氧化剂是KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)═SO2(g);△H1 S(g)+O2(g)═SO2(g);△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
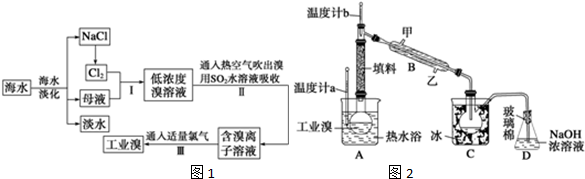
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
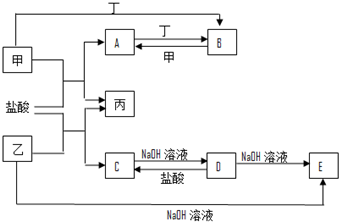
 ;组成单质丁的元素的原子结构简图为
;组成单质丁的元素的原子结构简图为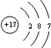 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com