
分析 (1)含元素的化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,根据化合价的变化计算转移的电子数;
(2)NaHCO3不稳定,加热易分解,生成碳酸钠、水和二氧化碳;
(3)过氧化钠与水反应放出大量热,同时生成氧气.
解答 解:(1)①2F2+2H2O=4HF+O2中O元素的化合价由-2价升至0价,失去电子,被氧化,水作还原剂,反应中F的化合价由0价降低到-1价,得电子,被还原,F2作氧化剂,反应中转移电子数为4,则标出反应中电子转移的方向和数目为: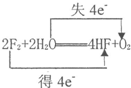 ;
;
故答案为: ;F2;H2O;
;F2;H2O;
②MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mole-,用双线桥法表示反应中电子转移的数目为 ,
,
故答案为: ;MnO2;HCl;
;MnO2;HCl;
(2)NaHCO3不稳定,加热易分解,生成碳酸钠、水和二氧化碳,其反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)在包有过氧化钠粉末的脱脂棉上滴加几滴水,过氧化钠与水反应生成氧气,同时放出大量热,使温度达到脱脂棉的着火点,脱脂棉燃烧;
故答案为:过氧化钠与水反应生成氧气并放出大量热,反应放出的热使脱脂棉燃烧,反应生成的氧气使脱脂棉的燃烧加剧.
点评 本题考查氧化还原反应、漂白粉的性质,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO 2分子比例模型: | B. | S 2-的结构示意图: | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | HCN分子的结构式:H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
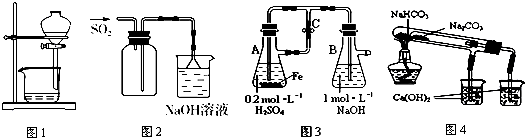
| A. | 图1用于放出碘的苯溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com