
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
分析 某芳香化合物的分子式为C8H10,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,若有1个侧链,为-CH2-CH3;若有2个侧链,为-CH3,有邻、间、对三种,分子中有几种等效氢原子,就有几种一氯代物,从而确定该有机物,然后在一氯代物的基础上,继续取代一个氢原子,据此分析.
解答 解:某芳香化合物的分子式为C8H10,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,
若有1个侧链,为-CH2-CH3,有一种,分子中有5种氢原子,一氯代物有5种;
若有2个侧链,为-CH3,有邻、间、对三种,分子中分别有3、4、2种氢原子,一氯代物分别有3、4、2种,
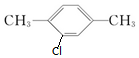
所以该有机物为对二甲苯,对二甲苯的一氯代物为: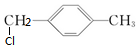 、
、
若一氯代物为 时,二氯代物有4种,如图所示,
时,二氯代物有4种,如图所示,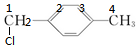 ;
;
若一氯代物为 时,二氯代物有3种,如图所示,
时,二氯代物有3种,如图所示,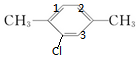 ;
;
所以该有机物的二氯代物有7种,故选A.
点评 本题考查了同分异构体数目的求算,题目难度较大,注意掌握等效氢的判断,明确有机物二氯代物可采用定1议2法求算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
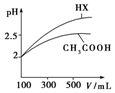 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
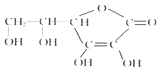 维生素C的结构简式如图所示:
维生素C的结构简式如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷跟氯气发生取代反应 | B. | 乙烯跟氯气发生加成反应 | ||
| C. | 乙烷跟氯化氢混合 | D. | 乙烯跟氯化氢发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| B. | 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是Cu | |
| C. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| D. | 将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以AlO2-的形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com