
已知酸性条件下有如下反应:2Cu+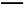 Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入 试剂 | 稀硫酸 | 浓硫酸、 加热 | 稀硝酸 | 浓硝酸 |
实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是( )
A.Cu B.一定有Cu,可能有Cu2O
C.Cu2O D.一定有Cu2O,可能有Cu
科目:高中化学 来源:2014高考化学名师知识点精编 专题19烃的衍生物基础营养物质练习卷(解析版) 题型:填空题
011年5月份,受到拉尼娜现象和全球大气环流异常共同作用的影响,我国南方出现了罕见的旱情,为此专家建议尽快发展高能抗旱保水剂用来调控农田水分和作物耗水,减缓水资源短缺和干旱的危害。已知有机物I为一种保水剂,可通过烃A经下列转化生成:
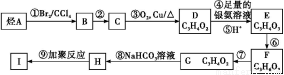
提示: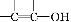 不能稳定存在。
不能稳定存在。
请回答下列问题:
(1)A和I的结构简式为:A ,I 。
(2)F中官能团的名称为: 。
(3)反应②和⑦的反应类型为:② ,⑦ 。
(4)反应④的化学方程式为 。
(5)M是一种普遍使用的抗生素类药物,它是由2个F分子在一定条件下脱去2个水分子形成的环状酯,写出该反应的化学方程式: 。
(6)D有两种能发生银镜反应且属于链状化合物的稳定同分异构体,请写出它们的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:选择题
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实验操作解释正确的是( )
选项现象或操作解释及结论
A将胆矾放入坩埚中加热脱水,晶体由蓝色变为白色胆矾晶体易失结晶水
B苯酚中滴加溴水有白色沉淀苯酚与溴发生了加成反应
C某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成说明该溶液中含有S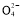
D蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口此位置指示的是被蒸馏物质的沸点
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
下列关于工业生产的说法中,不正确的是( )
A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅
B.生产普通水泥的主要原料有石灰石、石英和纯碱
C.工业上将粗铜电解精炼,应将粗铜连接电源的正极
D.在高炉炼铁的反应中,一氧化碳作还原剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:实验题
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
|
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为( )
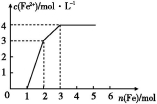
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S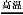 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
A.反应中Al2(SO4)3被氧化
B.Al2 (SO4)3、Al2O3均含有离子键和共价键
C.5.1 g Al2O3含有9.03×1022个阴离子
D.该反应中,每转移0.3 mol电子生成5.04 L SO2
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C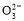 。下列叙述正确的是( )
。下列叙述正确的是( )
A.放电时C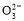 向正极移动
向正极移动
B.放电时OH-向负极移动
C.负极反应为H2+C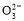 -2e-=H2O+CO2
-2e-=H2O+CO2
D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L 时,转移电子4 mol
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生
D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com