

| A. | H2R是二元弱酸,其Ka1=1×10-2 | |
| B. | NaHR在溶液中水解程度小于电离程度 | |
| C. | pH<7.2的溶液中一定存在:c( Na+)>c( HR-)>c(R2-)>c(H+)>c(OH-) | |
| D. | 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
分析 A.据pH=2时各离子浓度计算Ka1;
B.NaHR溶液显酸性可知其电离程度大于其水解程度;
C.pH=7.2时,c( HR-)=c(R2-);
D.pH=7.2时,Na2R与NaHR溶液浓度相同.
解答 解:A.据图可知pH=2时,Ka1=$\frac{c({H}^{+})×c(H{R}^{-})}{c({H}_{2}R)}$=$\frac{1×1{0}^{-2}×0.5}{0.5}$=1×10-2,故A正确;
B.NaHR溶液显酸性,以电离为主,可知其电离程度大于其水解程度,故B正确;
C.由图可知,pH=7.2时,c( HR-)=c(R2-),溶液显碱性,即c(OH-)>c(H+),故C错误;
D.Na2R与NaHR溶液浓度相同时,其pH=7.2,故D正确;
故选C.
点评 本题考查了据图分析数据进行电离平衡常数的计算、电离程度与水解程度大小判断以及电荷守恒的应用,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握图象中的信息.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与氧元素形成的化合物一定属于碱性氧化物 | |
| B. | 最高价氧化物对应的水化物的酸性:E>D>A | |
| C. | 简单氢化物的沸点:E>B | |
| D. | 原子半径:C>D>E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNa2O和Na2O2混合物中含有的阴阳离子总数大于3NA | |
| B. | 常温常压下,20gD2O分子中所含中子数为10NA | |
| C. | 50ml12mol•L-1的盐酸与足量的MnO2共热转移的电子数为0.3 NA | |
| D. | 密闭容器中2mol NO和Imol的O2,充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
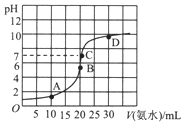 常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )
常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )| A. | 在B点时:c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 在C点时:c(Cl-)<c(NH4+)+c(NH3•H2O) | |
| C. | A点与B点相比:2n(NH4+)>n(NH4+) | |
| D. | 从C到D的过程中,可能出现:c(Cl-)>c(NH4+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com