
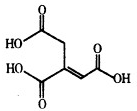
 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )| A. | 乌头酸与醋酸是同系物 | |
| B. | 乌头酸中碳元素的质量分数为41.4% | |
| C. | 乌头酸能发生中和反应、水解反应、酯化反应 | |
| D. | 含1mol乌头酸的溶液最多可消耗3mol NaOH、3mol Br2 |
分析 由结构简式可知分子式,以此可确定含碳量,分子中含-COOH、碳碳双键,结合羧酸、烯烃性质来解答.
解答 解;A.分子中含有3个羧基,与醋酸官能团数目不同,不是同系物,故A错误;
B.由结构简式可知分子式为C6H6O6,则碳元素的质量分数为$\frac{6×12}{6×12+6+6×16}×100%$=41.4%,故B正确;
C.分子中不含能发生水解的官能团,故C错误;
D.含有3个羧基、1个碳碳双键,则含1mol乌头酸的溶液最多可消耗3mol NaOH、1mol Br2,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸的性质考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol(L•min) | B. | v(B)=0.05 mol(L•s) | ||
| C. | v(C)=0.80 mol(L•min) | D. | v(D)=0.85 mol(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;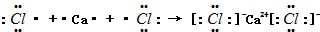 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
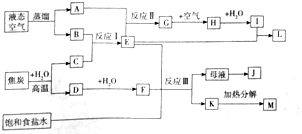
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 2.5 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 | |
| B. | 向0.1mol•L-1Na2CO3溶液中加入少量NaOH固体,c(CO32-)与c(Na+)的增大 | |
| C. | NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下,$\frac{{K}_{W}}{c{(H}^{+})}$=0.1mol•L-1 的溶液中,Na+、K+、CO32-、NO3-、离子可大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性:Y>W | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 原子半径:Y<Z | |
| D. | Y最高价氧化物能与W的最高价氧化物的水化物的溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com