
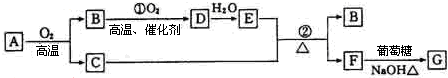
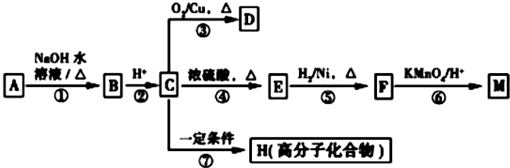
分析 “G为砖红色沉淀”是本题的突破口,应为Cu2O,因此此题可以用逆向推断的方法做,转化关系中,F生成G的反应是醛基的检验,所以,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,从平衡移动的角度计算平衡时各物质的浓度,进而计算化学平衡常数以及判断各物质的浓度的变化.
解答 解:(1)“G为砖红色沉淀”是本题的突破口,应为Cu2O,因此此题可以用逆向推断的方法做.不难看出,F生成G的反应是醛基的检验,所以,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,C为Cu;
故答案为:SO2;H2SO4;
(2)B为SO2,对应的溶液呈酸性,1mol/L的B的水溶液中水电离的c(H+)为2×10-13mol/L,则C(OH-)=2×10-13mol/L,
溶液中c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-13}}$mol/L=0.05mol/L,
pH=1.3,
故答案为:1.3;
(3)反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)依据化学方程式:
2SO2+O2 $\frac{\underline{催化剂}}{△}$ 2SO3
起始c(mol/L) 0.23 0.11 0
转化c(mol/L) 0.12 0.06 0.12
第一次 平衡 c(mol/L) 0.11 0.05 0.12
可以求得:K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2}){c}^{2}(S{O}_{2})}$=$\frac{0.1{2}^{2}}{0.05×0.1{1}^{2}}$=23.8(l/mol)
恒温、恒容条件下,加入0.50 mol O2后,根据勒夏特列原理,平衡右移,SO2的物质的量减少,浓度减小,体积分数减小,O2本身的转化率降低.设此时转化xmol/L的 O2,
2SO2+O2 $\frac{\underline{催化剂}}{△}$ 2SO3
起始 (mol/L) 0.11 0.05+0.50 0.12
转化 (mol/L) 2x x 2x
第二次平衡 (mol/L) 0.11-2x 0.55-x 0.12+2x
第一次平衡时SO3的体积分数为:$\frac{0.12}{0.11+0.05+0.12}$=0.429,
只要注意到可逆反应中任意物质的浓度不可能为零的特点,x的最大极限值为0.055 mol/L,所以第二次平衡时SO3的体积分数最大为:$\frac{0.12+2x}{0.11-2x+0.55-x+0.12+2x}$=0.320,
显然,体积分数减小了.
故答案为:23.8L/mol;减小;降低;减小.
点评 本题考查了物质转化关系和物质性质的应用,为高频考点,侧重于学生的分析、计算能力的考查,掌握化学平衡的计算应用和变化判断方法.本题考查较为综合,题目难度较大,注意根据物质的特殊颜色推断物质的可能性,用逆推的方法进行推断,把握常见元素化合物的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 如图所示的ECC水泥是最新研制出来的,其最明显的特征是可以在弯曲状态下承受相当大的压力,因为材料里面有特殊制成的聚合体纤维微粒,所以ECC水泥可以在承受较大压力的状态下弯曲而不破裂.则聚合体纤维微粒在该材料中的作用是( )
如图所示的ECC水泥是最新研制出来的,其最明显的特征是可以在弯曲状态下承受相当大的压力,因为材料里面有特殊制成的聚合体纤维微粒,所以ECC水泥可以在承受较大压力的状态下弯曲而不破裂.则聚合体纤维微粒在该材料中的作用是( )| A. | 做粘合剂,起粘合作用 | B. | 做增强体,起骨架作用 | ||
| C. | 做导电体,起导电作用 | D. | 做原子晶体,起耐热作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO 和CO2 | D. | NO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 颜色褪成无色 | B. | 浅绿色逐渐加深 | C. | 没有变化 | D. | 变为棕黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 用100ml量筒量取9.5 mL的液体 | |
| D. | 焰色反应中,观察焰色后应趁热将铂丝插入到稀硫酸中,然后再次灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
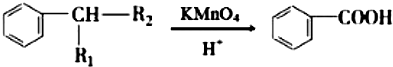 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)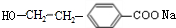 .
.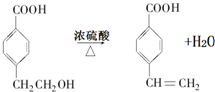 .
.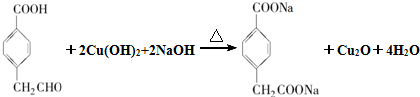 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com