
| A. | a (A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a (B)=a′(B) | ||
| C. | a (A)<a′(A) a (B)=a′(B) | D. | a (A)=a(A) a (B)>a′(B) |
分析 A容器中发生反应:N2O4?2NO2,在该平衡体系中再充入0.2molN2O4,恒温恒容下等效为在原平衡基础上压强增大一倍,平衡逆向移动;
B容器中发生:2HI(g)?H2(g)+I2(g),平衡体系中再充入0.2molHI,恒温恒容效为在原平衡基础上压强增大一倍,反应前后气体物质的量不变,平衡不移动.
解答 解:A容器中发生反应:N2O4?2NO2,在该平衡体系中再充入0.2molN2O4,恒温恒容下等效为在原平衡基础上压强增大一倍,平衡逆向移动,N2O4的分解率减小,即a (A)>a′(A);
B容器中发生:2HI(g)?H2(g)+I2(g),平衡体系中再充入0.2molHI,恒温恒容效为在原平衡基础上压强增大一倍,反应前后气体物质的量不变,平衡不移动,HI的分解率不变,即a (B)=a′(B),
故选:B.
点评 本题考查化学平衡有关计算,涉及等效平衡问题,关键是对等效平衡理解构建平衡建立的途径,难度中等.


科目:高中化学 来源: 题型:选择题
| 实验方法 | 实验方案 | 测量数据 | |
| A | 滴定法 | 将样品配成100 mL溶液,取10 mL,加入甲基橙,用 标准盐酸滴定 | 消耗盐酸的体积 |
| B | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C | 重量法 | 样品放入烧瓶中,置于天平上,加入足量盐酸 | 减轻的质量 |
| D | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2A是弱酸 | |
| B. | 稀释0.1mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1mol/L的H2A溶液中,c(H+)=0.12mol/L | |
| D. | 若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,则0.1mol/L的H2A溶液中c(H+)<0.12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
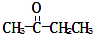 )、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.
)、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 50% | C. | 75% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2体积不变 | B. | 剩余三分之一体积一氧化氮气体 | ||
| C. | 溶液充满集气瓶 | D. | 二氧化氮和一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硝酸银溶液 硝酸钡溶液 稀硝酸 | B. | 氯化钡溶液 稀硝酸 硝酸银溶液 | ||
| C. | 氢氧化钠溶液 硝酸银溶液 稀硝酸 | D. | 氯化钡溶液 硝酸银溶液 稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com