
| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | pH=pOH的溶液(pOH是OH-浓度的负对数) | |
| C. | pH=14-pOH的溶液 | |
| D. | 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
分析 溶液一定呈中性,说明溶液中c(H+)=c(OH-),不能根据pH、氢离子或氢氧根离子浓度大小判断溶液酸碱性,据此分析解答.
解答 解:A.c(H+)=1×10-7mol/L的溶液可能呈酸性、碱性或中性,如果c(H+)=c(OH-),则溶液呈中性,如果c(H+)>c(OH-),则溶液呈酸性,如果c(H+)<c(OH-),则溶液呈碱性,故A错误;
B.pH=pOH的溶液(pOH是OH-浓度的负对数),说明溶液中存在c(H+)=c(OH-),则溶液呈中性,故B正确;
C.pH=14-pOH的溶液可能呈酸性、碱性或中性,要根据c(H+)、c(OH-)的相对大小判断,故C错误;
D.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液,如果酸是强酸,则溶液呈中性,如果酸是弱酸,则溶液呈碱性,故D错误;
故选B.
点评 本题考查溶液酸碱性判断,溶液酸碱性要根据c(H+)、c(OH-)的相对大小判断,温度未知时不能根据pH与7的相对大小判断,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
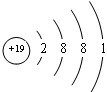 .
.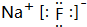 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
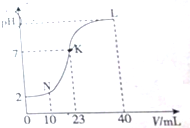
| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含电子数约为40NA | |
| B. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| C. | 48gO2,O3混合气体含有的氧原子数为3NA | |
| D. | 1molCl2作为氧化剂得到的电子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其钠盐的化学式为Na2X | B. | 最高价氧化物对应水化物为碱 | ||
| C. | X是金属元素 | D. | X单质是能导电的固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com