
 .
.
分析 A是宇宙中最丰富的元素,A为氢元素,D原子得一个电子填入3p轨道后,3p轨道全充满,则D为17号元素,氯元素;B和D的原子都有1个未成对电子,B+比D少一个电子层,则B为钠元素;E原子的2p轨道中有3个未成对电子,则E为氮元素;G位于周期表第6纵行且是六种元素中原子序数最大的在前四周期的,则G为铬元素;F的最高化合价和最低化合价的代数和为4,且原子序数小于铬元素,则F为硫元素;R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2:1;则R为Na2S,所以,A为氢,B为钠,D为氯,E为氮,F为硫,G为铬,据此答题.
解答 解:A是宇宙中最丰富的元素,A为氢元素,D原子得一个电子填入3p轨道后,3p轨道全充满,则D为17号元素,氯元素;B和D的原子都有1个未成对电子,B+比D少一个电子层,则B为钠元素;E原子的2p轨道中有3个未成对电子,则E为氮元素;G位于周期表第6纵行且是六种元素中原子序数最大的在前四周期的,则G为铬元素;F的最高化合价和最低化合价的代数和为4,且原子序数小于铬元素,则F为硫元素;R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2:1;则R为Na2S,所以,A为氢,B为钠,D为氯,E为氮,F为硫,G为铬,
(1)根据元素周期律可知氯的电负性大于硫,故答案为:>;
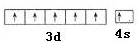
(2)铬为24号元素,价电子排布图为 ,故答案为:
,故答案为: ;
;
(3)晶体钠为体心立方堆积,区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验,
故答案为:体心立方堆积;X-射线衍射;
(4)根据核外电子排布规律可知,每个电子的运动状态都不相同,氯离子最外层有8个电子,所以就有8种不同运动状态的电子,最外层有两个能级,每个能级上电子能量是相同的,所以最外层有2种能量不同的电子,在S2Cl2中要使各原子都满足8电子稳定结构,则分子存在一个硫硫键和两硫氯键,则硫原子的价电子对数为4,所以硫原子按sp3方式杂化,硫原子周围有两对孤电子对,所以分子为极性分子,
故答案为:8;2;sp3;极性;
(5)A与E形成的最简单化合物为氨气,氨分子中氮原子周围有三个共价键,一个孤电子对,所以分子空间构型为三角锥形,由于在氨分子中有孤电子对的存在,分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性,所以分子显极性,
故答案为:三角锥形;分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性;
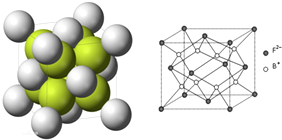
(6)R为Na2S,在每个晶胞中含有钠离子数为8,硫离子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,R的晶胞如图所示,设S2-半径为r1 cm,Na+半径为r2cm,则晶胞的体对角线为4(r1cm+r2cm),晶胞的边长为$\frac{4}{\sqrt{3}}$(r1cm+r2cm),晶体的密度为$\frac{\frac{4×78}{{N}_{A}}}{({\frac{4}{\sqrt{3}})^{3}({r}_{1}+r{\;}_{2})}^{3}}$g/cm3,
故答案为:$\frac{\frac{4×78}{{N}_{A}}}{({\frac{4}{\sqrt{3}})^{3}({r}_{1}+r{\;}_{2})}^{3}}$g/cm3.
点评 本题主要考查了原子核外电子排布、晶体的堆积方式、分子结构与性质、晶胞密度的有关计算等知识,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.
工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠能发生水解反应,可用作食品的膨松剂 | |
| B. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| C. | O3能使蛋白质发生变性,可用于杀菌、消毒 | |
| D. | SO2具有漂白性,可用KMn04标准溶液滴定食品中S02残留量. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com