
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+转化为Fe3+,下列物质可作氧化剂的是__(填字母)。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液pH至4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用___(填字母)。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH至4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就被认定为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5mol·L-1]时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。
【答案】B CD 4 3 可行
【解析】
(1)加入合适的氧化剂,使Fe2+氧化为Fe3+,需要不能引入新的杂质;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀;
(2)依据氢氧化铜饱和溶液中溶度积常数计算溶液中的氢离子浓度计算Cu(OH)2开始沉淀时溶液的pH;结合氢氧化铁溶度积和残留在溶液中的离子浓度小于1×10-5molL-1时就认为沉淀完全,计算Fe(OH)3沉淀完全时的pH。
(1)①加入合适的氧化剂,使Fe2+氧化为Fe3+,但不能引入新的杂质,A、C、D中会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故只有B符合,故答案为:B;
②调整溶液至pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C、D均可,A、B能够将铜离子也转化为沉淀,不符合,故答案为:CD;
(2)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0molL-1,c(Cu2+)=3.0molL-1,依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20;c2(OH-)=![]() =10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14,则c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=1.0×10-38,c(Fe3+)×c3(OH-)=1.0×10-38;c3(OH-)=
=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14,则c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=1.0×10-38,c(Fe3+)×c3(OH-)=1.0×10-38;c3(OH-)=![]() =1.0×10-33,则c(OH-)=1×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=1×10-3mol/L,则pH=3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,故答案为:4;3;可行。
=1.0×10-33,则c(OH-)=1×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=1×10-3mol/L,则pH=3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,故答案为:4;3;可行。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题
(1)FeCl3溶液呈酸性原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)> c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为________________________。(填序号)
(4)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是( )
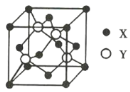
A.该晶体属于原子晶体
B.X2+的配位数为8,Y2-的配位数为4
C.与每个Y2-距离最近且相等的Y2-共有12个
D.该晶体的熔点比氧化锌高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:

已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备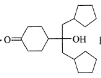 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2和浓盐酸制氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
(1)该反应中氧化剂和氧化产物的物质的量之比为_________。
(2)该反应中,若有0.2 mol HCl被氧化,能生成标准状况下Cl2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO42- |
实验Ⅰ:取少量该强酸性溶液A进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液A,向该溶液中滴加1 mol·L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
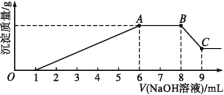
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有________种。
(2)通过实验Ⅰ可以确定该溶液中一定存在的阴离子是_________。检验气体X的方法是_______________;沉淀Z的化学式为_____________。
(3)写出实验Ⅱ的图示中BC段对应反应的离子方程式:________________。
(4)A点对应的固体质量为____ g。
(5)通过上述信息,推算该溶液中阴离子的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
![]() O2(g) +H2(g) =H2O(g)
O2(g) +H2(g) =H2O(g) ![]() H=-242kJ·mol-1
H=-242kJ·mol-1
S(g)+ H2(g) =H2S(g) ![]() H=-20kJ·mol-1
H=-20kJ·mol-1
Se(g)+H2(g)![]() H2Se(g)
H2Se(g) ![]() H=+81kJ·mol-1
H=+81kJ·mol-1
下列说法正确的是
A. 稳定性:H2O< H2S< H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g)+2H2S(g)=2H2O(g)+2S(g) ![]() H=-444 kJ·mol-1
H=-444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:
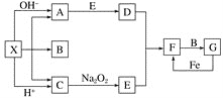
(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com