
【题目】某烷烃和单烯烃的混合气体2.24L,将其完全燃烧,产生的气体缓缓通过浓硫酸,浓硫酸增重4.05克,将剩余气体通入碱石灰,碱石灰质量增加了6.60克,另取该混合气体2.24L通过过量溴水,溴水质量增加了1.05克。
(1)混合气体由哪两种烃组成____?
(2)两种烃的体积分数各是多少______?
【答案】CH4和C3H6 CH4:75%,C3H6:25%
【解析】
根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,其质量可以根据澄清石灰水质量增加量来确定,有机物中的氢全部转化为水,其质量可以根据浓硫酸质量增加来确定,烯烃和溴单质能发生加成反应,溴水质量增加量就是烯烃的质量,根据水以及二氧化碳的量可以确定碳和氢原子的个数之比。
(1)混合气体的物质的量为![]() =0.1mol;燃烧后通过浓H2SO4,增重的质量即水的质量为4.05g,即
=0.1mol;燃烧后通过浓H2SO4,增重的质量即水的质量为4.05g,即![]() =0.225mol,再通过碱石灰,增重的质量即生成CO2的质量为6.60g,即
=0.225mol,再通过碱石灰,增重的质量即生成CO2的质量为6.60g,即![]() =0.15mol;取0.1mol混合物通入溴水,增重的质量即烯烃的质量为1.05g.所以设烷烃、烯烃分别为CxH2x+2、CyH2y,且两种烃的物质的量分别为a,b,则有:1.05g=14yg/mol×b;a+b=0.1mol;(2x+2)a+2yb=0.225mol×2((H守恒);ax+by=0.15mol(C守恒);解得x=1,y=3,a=0.075mol,b=0.025mol,所以烷烃为CH4;
=0.15mol;取0.1mol混合物通入溴水,增重的质量即烯烃的质量为1.05g.所以设烷烃、烯烃分别为CxH2x+2、CyH2y,且两种烃的物质的量分别为a,b,则有:1.05g=14yg/mol×b;a+b=0.1mol;(2x+2)a+2yb=0.225mol×2((H守恒);ax+by=0.15mol(C守恒);解得x=1,y=3,a=0.075mol,b=0.025mol,所以烷烃为CH4;
(2)烯烃为C3H6,CH4的体积分数为![]() ×100%=75%;C3H6的体积分数为
×100%=75%;C3H6的体积分数为![]() ×100%=25%。
×100%=25%。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。
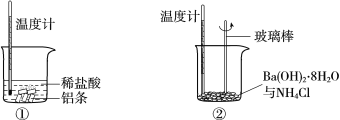
请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)①中反应的离子方程式是_________,该反应的还原剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列关于溶液中的量的关系判断正确的是
A. H+浓度:10c(H+)甲=c(H+)乙 B. OH-浓度:c(OH-)甲=10c(OH-)乙
C. 溶液浓度:c(甲)>10c(乙) D. 与等量NaOH反应耗酸体积:10V(甲)>V(乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+由H、C、N三种元素组成,结构如下图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为______,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,NH3、![]() 、
、![]() 中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是____________。
中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是____________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+中,碳原子的杂化轨道类型为________。分子中的大π键可用符号![]() 表示,其中n代表参与形成的大π键原子数,m代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中n代表参与形成的大π键原子数,m代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+中的大π键应表示为________。
),则EMIM+中的大π键应表示为________。
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如下图所示。立方氮化硼属于______晶体,其中硼原子的配位数为_____。已知:立方氮化硼密度为d g/cm3,B原子半径为x pm,N原子半径为y pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为_______(列出化简后的计算式)。
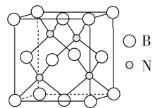
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:
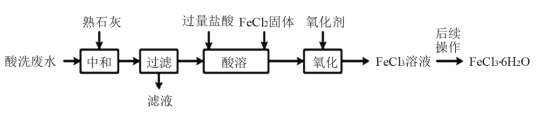
相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 | 4.3 | 7.6 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 | 5.6 | 9.6 |
回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如图(b)所示,实际生产中固液比选择1.5:1的原因是___________。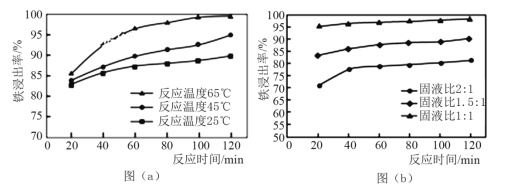
(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为__________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为__________,电解总反应的离子方程式是 __________。
(5)将得到的FeCl3溶液在HCl气氛中______、______、过滤、洗涤、干燥得FeCl36H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

已知:![]() +CH3Cl
+CH3Cl![]() +HCl
+HCl
请回答下列问题:
(1)F的化学名称是__,②的反应类型是___。
(2)D中含有的官能团是__(写名称),D聚合生成高分子化合物的结构简式为___。
(3)反应③的化学方程式是___。
(4)反应⑥的化学方程式是___。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___。
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)___。
[示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br]
BrCH2CH2Br]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
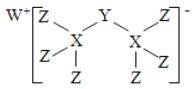
A. X、Z两元素可形成离子化合物
B. 气态氢化物的稳定性:X>Y>Z
C. 该新化合物中的Y元素满足8电子稳定结构
D. Y、Z元素分别对应的最高价氧化物的水化物均是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
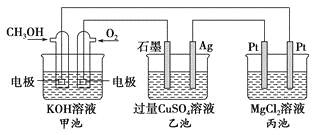
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人民网报道,浙江温岭一河流氨氮超标五倍,河水黑如墨水。氮氧化物污染日益严重,请分析下列有关NO、NO2等的试题,然后填空。
(1)下图所示为N2(g)和O2(g)生成NO(g)过程中的能量变化。
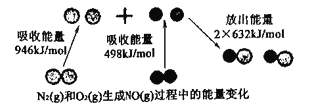
由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式____________
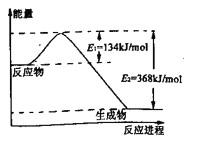
(2)下图是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________.
(3)已知:在298K、101kPa下,由稳定的单质生成1mol化合物的反应热叫做该化合物的生成热。如图为氧族元素(除钋外)的氢化物a、b、c、d的生成热数据示意图
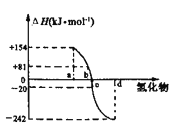
①请归纳:非金属元素的气态氢化物的稳定性与氢化物的生成热(ΔH)之间的关系______________________________
②写出硒化氢在298K、101kPa时发生分解反应的热化学反应方程式__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com