
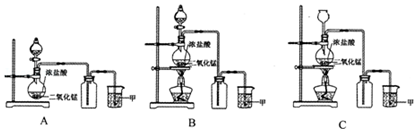
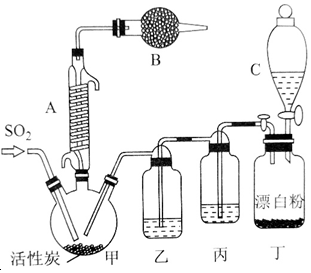
·ÖĪö £Ø1£©ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį¹²Čȵķ½·ØÖĘČ”ĀČĘų£¬ĀČĘų±ČæÕĘųÖŲ£¬ÓĆĻņÉĻÅÅĘų·ØŹÕ¼Æ£»
£Ø2£©¶žŃõ»ÆĆĢŗĶÅØŃĪĖį¹²Čȵķ½·ØÖĘČ”ĀČĘų£¬·“Ó¦ÖŠ¶žŃõ»ÆĆĢ±»»¹ŌĪŖMnCl2£»
£Ø3£©ĀČĘųŹĒÓŠ¶¾µÄĪŪČ¾ŠŌĘųĢ壬²»ÄÜÅŷŵ½æÕĘųÖŠ£¬ŠčŅŖÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ£»
£Ø4£©ĀČĘųĶłĶłŗ¬ÓŠHClŗĶH2OŌÓÖŹ£¬ĻČ³żĀČ»ÆĒā£¬ŌŁ³żĖ®£¬ĘäÖŠŗ¬ÓŠµÄHClŌÓÖŹæÉŅŌÓƱ„ŗĶŹ³ŃĪĖ®ĪüŹÕ£¬Ė®ÓĆÅØĮņĖįĪüŹÕ£®
½ā“š ½ā£ŗ£Ø1£©ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį¹²Čȵķ½·ØÖĘČ”ĀČĘų£¬ĀČĘų±ČæÕĘųÖŲ£¬ÓĆĻņÉĻÅÅĘų·ØŹÕ¼Æ£¬×°ÖĆAĪŽ¼ÓČČ×°ÖĆ£¬B·ūŗĻÖʱø×°ÖĆ£¬CÖŠĀČĘų»į“Ó³¤¾±Ā©¶·ÖŠÅܳö£¬
¹Ź“š°øĪŖ£ŗB£»
£Ø2£©¶žŃõ»ÆĆĢŗĶÅØŃĪĖį¹²Čȵķ½·ØÖĘČ”ĀČĘų£¬·“Ó¦ÖŠ¶žŃõ»ÆĆĢ±»»¹ŌĪŖMnCl2£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMnO2+4HCl£ØÅØ£©$\frac{\underline{\;¼ÓČČ\;}}{\;}$MnCl2+Cl2”ü+2H2O£¬
¹Ź“š°øĪŖ£ŗMnO2+4HCl£ØÅØ£©$\frac{\underline{\;¼ÓČČ\;}}{\;}$MnCl2+Cl2”ü+2H2O£»
£Ø3£©ĀČĘųŹĒÓŠ¶¾µÄĪŪČ¾ŠŌĘųĢ壬²»ÄÜÅŷŵ½æÕĘųÖŠ£¬ŠčŅŖÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2NaOH+Cl2ØTNaCl+NaClO+H2O£¬
¹Ź“š°øĪŖ£ŗĒāŃõ»ÆÄĘČÜŅŗ£»2NaOH+Cl2ØTNaCl+NaClO+H2O£»
£Ø4£©ÅØŃĪĖįŅ×»Ó·¢£¬ĖłŅŌÖʵƵÄĀČĘųÖŠĶłĶłŗ¬ÓŠHClŗĶH2OŌÓÖŹ£¬ĘäÖŠŗ¬ÓŠµÄHClŌÓÖŹ¼«Ņ×ČÜÓŚĖ®£¬ĀČĘųŌŚ±„ŗĶŹ³ŃĪĖ®ÖŠČܽā¶Č²»“ó£¬æÉŅŌÓƱ„ŗĶŹ³ŃĪĖ®ĪüŹÕ£¬Ė®ÓĆÅØĮņĖįĪüŹÕ£¬
¹Ź“š°øĪŖ£ŗHClŗĶH2O£»±„ŗĶŹ³ŃĪĖ®”¢ÅØĮņĖį£®
µćĘĄ ±¾Ģāæ¼²éĮĖŹµŃéŹŅÖʱøĀČĘųµÄ·½·ØŗĶŌĄķ·ÖĪöÅŠ¶Ļ£¬Ö÷ŅŖŹĒ×°ÖĆŃ”ŌńŗĶ·“Ó¦»Æѧ·½³ĢŹ½ŹéŠ“£¬ÕĘĪÕ»ł“”ŹĒ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ±ąŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü |
| ²Ł×÷Ź¾ ŅāĶ¼ | 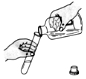 |  | 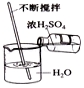 |  |
| ²Ł×÷Ćū³Ę | Ēćµ¹ŅŗĢå | Č”ÓĆæéד¹ĢĢå | Ļ”ŹĶÅØĮņĖį | ¼ģ²éĘųĆÜŠŌ |
| A£® | ¢Ł | B£® | ¢Ś | C£® | ¢Ū | D£® | ¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=1µÄČÜŅŗÖŠ£ŗNa+”¢Fe3+”¢NO3-”¢I- | |
| B£® | Ė®µēĄė³öµÄc£ØH+£©=1”Į10-12mol•L-1µÄČÜŅŗÖŠ£ŗK+”¢Al3+”¢Cl-”¢SO42- | |
| C£® | c£Ø Al 3+£©=0.1 mol•L-1µÄČÜŅŗÖŠ£ŗNa+”¢K+”¢HCO3-”¢Cl- | |
| D£® | ¼ÓČėKSCNČÜŅŗĻŌŗģÉ«µÄČÜŅŗ£ŗK+”¢NH4+”¢Cl-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 25”ę”¢101KPaŹ±£¬16g O2ŗĶO3»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄŌ×ÓŹżĪŖNA | |
| B£® | 1 mol NH3ÖŠŗ¬ÓŠµÄÖŹ×ÓŹżĪŖ17NA | |
| C£® | 11.2 L O2ŗĶN2µÄ»ģŗĻĘųĢåŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA | |
| D£® | ½šŹōĢśÓėĻ”ŃĪĖį·“Ó¦µ±²śÉś0.1 mol H2Ź±×ŖŅʵē×ÓŹżĪŖ0.3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź³“׳żĖ®¹ø | B£® | Ź³ĪļøÆĄĆ | ||
| C£® | ŌŚøßĪĀĻĀÓĆš¤ĶĮÉÕÖĘĢÕ“É | D£® | ·ÖŅŗ·Ø·ÖĄėĖÄĀČ»ÆĢ¼ÓėĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ÓŠ¹ŲŠÅĻ¢ČēĻĀ£ŗĮņõ£ĀČĶس£Ģõ¼žĻĀĪŖĪŽÉ«ŅŗĢ壬ČŪµćĪŖ-54.1”ę£¬·ŠµćĪŖ69.1”ę£¬ŌŚ³±ŹŖæÕĘųÖŠ”°·¢ŃĢ”±£»100”ęŅŌÉĻæŖŹ¼·Ö½ā£¬Éś³É¶žŃõ»ÆĮņŗĶĀČĘų£¬³¤ĘŚ·ÅÖĆŅ²»į·¢Éś·Ö½ā£®»Ų“šĻĀĮŠĪŹĢā£ŗ
ÓŠ¹ŲŠÅĻ¢ČēĻĀ£ŗĮņõ£ĀČĶس£Ģõ¼žĻĀĪŖĪŽÉ«ŅŗĢ壬ČŪµćĪŖ-54.1”ę£¬·ŠµćĪŖ69.1”ę£¬ŌŚ³±ŹŖæÕĘųÖŠ”°·¢ŃĢ”±£»100”ęŅŌÉĻæŖŹ¼·Ö½ā£¬Éś³É¶žŃõ»ÆĮņŗĶĀČĘų£¬³¤ĘŚ·ÅÖĆŅ²»į·¢Éś·Ö½ā£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com