
| A. | Na+ | B. | H2O | C. | F | D. | Ne |
科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花产生的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 废旧电池应集中回收,并填埋处理 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
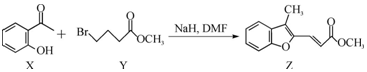
| A. | 物质X中所有碳原子可能在同一平面内 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 质子数一定相同,质量数和中子数一定不相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该溶液中加入pH=3的盐酸溶液,溶液的pH值减小 | |
| B. | 向该溶液中加入蒸馏水,CH3COOH和水的电离程度均增加 | |
| C. | CH3COOH(aq)?CH3COO-(aq)+H+(aq),Ka=1.0×10-5 | |
| D. | 0.1mol/L的CH3COONa溶液,溶液的pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com