
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:
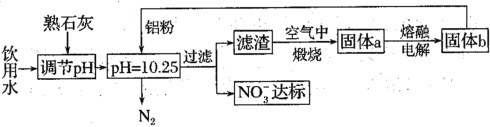
①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):
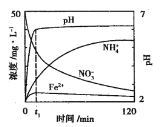
①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
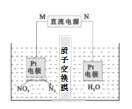
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。
(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
【答案】熟石灰价格便宜 2Al+2OH-+2H2O![]() 2AlO2-+3H2↑ 10:3 4Fe +NO3-+10H+=4Fe2++NH4++3H2O 铁粉与活性碳粉形成原电池加快还原NO3-的反应速率 正 2NO3-+12H++10e-=N2↑+ 6H2O Cl-在阳极上被氧化成Cl2(或游离氯),与阴极生成的NH4+反应生成N2
2AlO2-+3H2↑ 10:3 4Fe +NO3-+10H+=4Fe2++NH4++3H2O 铁粉与活性碳粉形成原电池加快还原NO3-的反应速率 正 2NO3-+12H++10e-=N2↑+ 6H2O Cl-在阳极上被氧化成Cl2(或游离氯),与阴极生成的NH4+反应生成N2
【解析】
从工业经济效益分析为什么用熟石灰;
从氢氧化铝的性质来分析为什么不能pH过大;
书写出铝和硝酸根反应的离子方程式得出氧化产物和还原产物比;
根据已知信息和氧化还原反应原理写出铁和硝酸反应离子方程式,在过程中加碳粉为何加快反应速率,从原电池原理分析;
从图像中得出化合价升降,分析阴阳极,继而分析连接正负极的关系,再书写出电极反应式,从文字信息和氯化钠加入电解思维来分析出为何去除铵根明显增强。
①工业生成要考虑经济效益,因此用熟石灰而不用NaOH调节pH的主要原因是熟石灰价格便宜,在调节pH时,若pH过大或过小都会造成Al的利用率降低,pH过大会使生成的氢氧化铝沉淀又溶解,pH过大造成Al利用率降低的离子方程式2Al+2OH-+2H2O![]() 2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O
2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O![]() 2AlO2-+3H2↑;
2AlO2-+3H2↑;
②在加入铝粉去除NO3-的反应中,10Al + 6NO3-+ 18H2O =10Al(OH)3 + 6OH- + 3 N2↑,因此氧化产物为10 mol Al(OH)3,还原产物为3 mol N2,因此它们的物质的量之比为10:3,故答案为:10:3;
⑵①t1时刻前,根据图像信息知生成了亚铁离子和铵根离子,因此离子方程式为4Fe +NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4Fe +NO3-+10H+=4Fe2++NH4++3H2O;
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能是由于形成原电池,加快反应速率,故答案为:铁粉与活性碳粉形成原电池加快还原NO3-的反应速率;
⑶根据图像信息,左边硝酸根变为氮气,则M化合价降低,在阴极发生还原反应,说明N为阳极,连接电源的正极,与直流电源M端相连的Pt电极上的电极反应式为2NO3-+12H+ +10e-=N2↑+ 6H2O,故答案为:正;2NO3-+12H+ +10e-=N2↑+ 6H2O;
⑷使NO3-变为NH4+,则硝酸根在阴极变为铵根离子,加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,说明铵根被反应了,可能是Cl-在阳极上被氧化成Cl2(或游离氯),与阴极生成的NH4+反应生成N2,故答案为:Cl-在阳极上被氧化成Cl2(或游离氯),与阴极生成的NH4+反应生成N2。


科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是___。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是_____________________________________。
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式___________________________________。
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL____mol/L____溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,通入SO2,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
向烧杯中分别加入25mL0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是______________________________。
(4)图2,BaCl2溶液中发生反应的离子方程式为_________。
(5)依据上述图像你得出的结论是________,说明理由_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法制取纯净水的过程如下图所示。
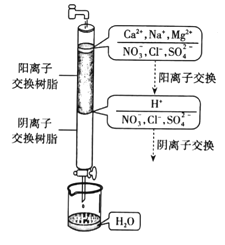
请根据图示回答下列问题:
(1)若水龙头中出来的是硬水,则其中含有较多的___离子。
(2)阳离子交换树脂中所含的大量阳离子是___,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目___(填“增多”、“减少”或“不变”)。
(3)水中的NO3、Cl、SO42,通过阴离子交换树脂转化为___离子,进而与H+反应生成H2O,有关反应的离子方程式为___。
(4)通过净化处理后,水的导电能力___(填“增强”、“减弱”或“不变”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁和硫酸亚铁的混合物中,若其中铁元素的质量分数为a%,则其中硫元素的质量分数为( )
A.![]() %B.
%B.![]() %C.
%C.![]() (100-a)%D.(100-3a)%
(100-a)%D.(100-3a)%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+4NO3(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数________(阿伏伽德罗常数用NA表示),放出的热量为_________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A. 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2
B. 使用高效催化剂可有效增大正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.往碘化亚铁中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸银溶液中加入过量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com