
| H+ |
| Fe2+ |
| OH- |
| 3 |
| ||
| 10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

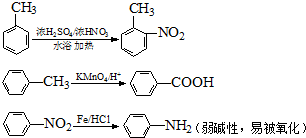
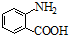 中官能团的名称
中官能团的名称 含苯环的同分异构体的结构简式
含苯环的同分异构体的结构简式
 分子中含有氯原子,按实验操作顺序,依次需要加入的试剂是
分子中含有氯原子,按实验操作顺序,依次需要加入的试剂是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g D2O 含有的质子数目为10NA |
| B、含有53gNa2CO3的溶液中,含离子数目为1.5NA |
| C、将0.1molFeCl3 制成Fe(OH)3胶体,生成的胶体粒子数为0.1NA |
| D、常温常压下,4.6gNO2气体含有的原子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解NaCl溶液时,阴极产生1mol Cl2的同时阳极产生1mol H2 |
| B、0.1mol?L-1 AlCl3溶液中Al3+的浓度为0.1mol?L-1 |
| C、7g 14C中所含中子数为4NA(设NA为阿伏加德罗常数的值) |
| D、2.24L氯气与足量NaOH稀溶液反应,转移0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 所用试剂 | 分离方法 |
| A | 苯 | 苯酚 | 足量浓溴水 | 过滤 |
| B | CH3CH2OH | CH3COOH | 足量CaO | 蒸馏 |
| C | C2H5Br | Br2 | 足量Na2SO3(aq) | 分液 |
| D | KCl | CaCl2 | 足量Na2CO3溶液、盐酸 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H3PO4>HNO3>HClO4 |
| B、热稳定性:HF>H2O>NH3 |
| C、离子半径:F->Na+>Mg2+ |
| D、还原性:HI>HBr>HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com