
 Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:分析 Ⅰ、(1)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)总反应的反应速率和转化率主要取决于飞乐速率慢的;
(3)判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,各组分浓度保持不变;
Ⅱ、①依据图象平衡转化率和化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
②反应是放热反应,温度越低平衡正向进行,氮气转化率增大,T1<T2,温度升高平衡常数减小;
③化学平衡常数只受温度的影响,温度不变,则K不变.
解答 解:Ⅰ、(1)①2NH3(g)+CO2(g)?NH2COONH4(l)△H=-117kJ•mol-1
②NH2COONH4(l)?(NH2)2CO(g)+H2O(g)△H=+15kJ•mol-1
依据盖斯定律①+②得到2NH3(g)+CO2(g)?(NH2)2CO(g)+H2O(g)△H=-102kJ•mol-1;
故答案为:2NH3(g)+CO2(g)?(NH2)2CO(g)+H2O(g)△H=-102kJ•mol-1;
(2)第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低,总反应的反应速率和转化率主要取决于第二步;
故答案为:第二步;
(3)对于第一步反应,2NH3(g)+CO2(g)?NH2COONH4(l)△H=-117kJ•mol-1,能判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,各组分浓度保持不变;
A.反应前后气体质量变化,物质的量变化,所以容器中气体的平均相对分子质量不随时间而变化,证明反应达到平衡状态,故A正确;
B.依据反应速率之比等于化学方程式计量数之比,表示的是正反应速率之比,υ正(NH3)=2υ逆(CO2),说明二氧化碳正反应速率和逆反应速率相同,故B正确;
C.反应生成液体,气体质量变化,体积不变化,容器中气体的密度不随时间而变化,能说明反应达到平衡状态,故C正确;
D.NH2COONH4(l)是液体,密闭容器中容器中的总质量守恒,容器中总质量不随时间而变化,不能说明反应达到平衡状态,故D错误;
故答案为:ABC;
Ⅱ、①反应达到平衡状态B时,氮气的转化率为20%,容器的容积10L,
N2(g)+3H2(g)═2NH3(g)
起始量(mol/L) 1 2.6 0
变化量(mol/L) 1×20%=0.2 0.6 0.4
平衡量(mol/L) 0.8 2 0.4
K=$\frac{0.{4}^{2}}{0.8×{2}^{3}}$=0.025,
故答案为:0.025;
②N2(g)+3H2(g)═2NH3(g)△H<0,反应是放热反应,温度越低平衡正向进行,氮气转化率增大,图象分析判断T1<T2,衡状态由A变到C时,温度升高平衡常数减小,所以平衡常数K(A)>K(C),
故答案为:>;
③化学平衡常数只受温度的影响,温度不变,则K不变,故答案为:=.
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析,平衡常数计算应用,图象分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基庚烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基庚烷 | |
| B. | 乙醇发生消去反应、乙醇氧化为乙醛、乙酸的酯化反应中均是C-O键发生断裂 | |
| C. | C3H6和C4H8在分子组成上相差CH2,所以二者互为同系物 | |
| D. | 荧光黄结构为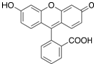 ,其分子式为C20H12O5,其中最多有9个碳原子共平面 ,其分子式为C20H12O5,其中最多有9个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32?)+c(H2CO3) | |
| C. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 在铁上镀铜,应选用铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
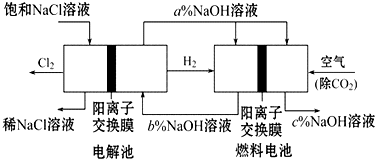 有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:
有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
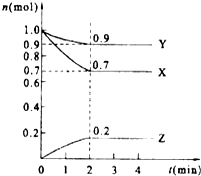 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中发生了化学变化 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com