
| A. | 0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2 | |
| B. | 一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA | |
| C. | 常温下18 g铝放入足量浓硫酸中转移电子数2 NA | |
| D. | 1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA |
分析 A、NO2气体中存在平衡:2NO2?N2O4;
B、二氧化硫和氧气的反应为可逆反应;
C、常温下,铝在浓硫酸中会钝化;
D、一个氢氧化铁胶体是多个氢氧化铁的聚集体.
解答 解:A、NO2气体中存在平衡:2NO2?N2O4,故最终得到的二氧化氮的物质的量小于0.1mol,故A错误;
B、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故得到的三氧化硫分子个数小于0.1NA个,故B错误;
C、常温下,铝在浓硫酸中会钝化,反应程度很小,故在浓硫酸中转移的电子数小于2NA个,故C错误;
D、一个氢氧化铁胶体是多个氢氧化铁的聚集体,故水解得到的氢氧化铁胶粒个数小于0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S | B. | SO2、NO2 | C. | CO2、NH3 | D. | SO2、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
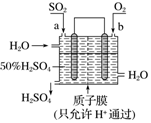
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中含σ键数为4 NA | |
| B. | 1mol Na2O2固体中含离子总数为4 NA | |
| C. | ag C2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{14}$ | |
| D. | 30g甲醛中含π键数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com