
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
分析 A.离子化合物中一定含有离子键,可能含有共价键;
B.分子的稳定性与共价键强弱有关;
C.单原子分子中不含共价键;
D.二氧化硅为酸性氧化物,其晶体属于原子晶体.
解答 解:A.离子化合物中一定含有离子键,可能含有共价键,如NaOH属于离子化合物含有离子键和共价键,故A错误;
B.分子的稳定性与共价键强弱有关,共价键越强,分子越稳定,与分子间作用力无关,故B错误;
C.单原子分子中不含共价键,如稀有气体分子中没有共价键,其晶体为分子晶体,晶体中只有分子间作用力,故C正确;
D.二氧化硅为酸性氧化物,其晶体属于原子晶体,所以酸性氧化物形成的晶体不一定分子晶体,故D错误.
故选C.
点评 本题考查化合物和化学键的关系,明确共价化合物和离子化合物的概念是解本题关键,注意二者的区别,难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
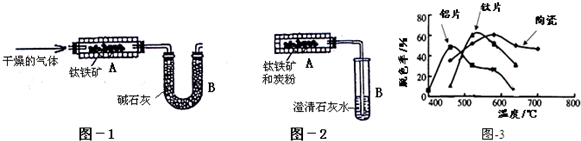
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
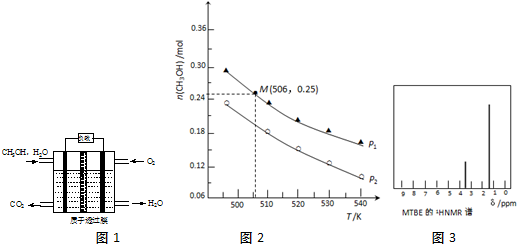
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
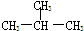
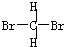 和
和 E.甲烷和庚烷F.
E.甲烷和庚烷F.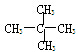 和C(CH)3
和C(CH)3 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若生成NA个水蒸气分子反应热为△H0,则△H0<△H | |
| B. | 当有20NA个电子转移时,放出2600kJ 热量 | |
| C. | 当有4NA个碳氧共用电子对生成时,放出1300kJ热量 | |
| D. | 上述反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
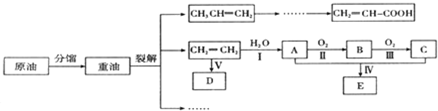
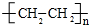 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
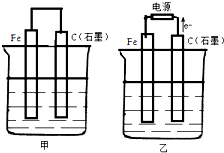 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com