
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、Ba(NO3)2 |
| C、Na2CO3 |
| D、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
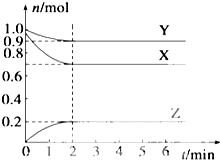 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A、该反应的化学方程式为3X+Y═2Z |
| B、2 min时,反应达最大限度,但化学反应仍在进行 |
| C、反应开始至2 min,Z的反应速率为0.10 mol?L-1?min-1 |
| D、反应达到平衡时,压强是开始时的0.9倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度不变时,增大反应物浓度可能增大活化分子的分子数 |
| B、其他条件不变时,升高温度能使分子获得更高的能量,活化分子百分数提高 |
| C、其他条件不变时,对于有气体参与和生成的反应而言,缩小体积增大体系的压强能增大单位体积内的活化分子百分数 |
| D、其他条件不变时,加人正催化剂能提高反应体系中含有的活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
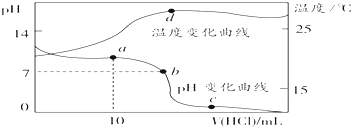 室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A、a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
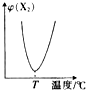 两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )
两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )| A、放热反应 |
| B、吸热反应 |
| C、可能是放热反应,也可能是吸热反应 |
| D、无法判断反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com