
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
| A、23g NO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| B、标准状况下,2.24L乙醇中含有的C-H数目为0.5NA |
| C、1mol?L-1的NaClO溶液中所含ClO-的数目为NA |
| D、室温下H2O2分解得到16g O2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g重水(D2O)中含NA个中子 |
| B、NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
| C、标准状况下,含有NA个分子的氧气和氮气的混和气体的体积约为22.4L |
| D、制取漂白粉的反应中,每消耗7.1g Cl2,则转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
| 药品 | 盐酸,硫酸 | 氢氧化钠,氢氧化钙 | 红磷,硫,铜,锌 | 氯化钠、磷酸钾 |
| A、甲橱 | B、乙橱 | C、丙橱 | D、丁橱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
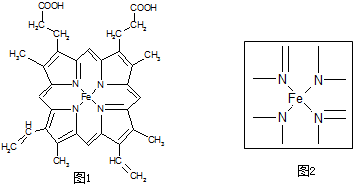
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com