
| A. | 0.10 | B. | 0.20 | C. | 0.30 | D. | 0.40 |
分析 发生反应为2CO+02$\frac{\underline{\;点燃\;}}{\;}$2C02,设出总体积为VL,利用极值法计算出CO和空气的体积,然后利用CO和氧气的量计算出反应后生成二氧化碳的量及反应后气体总体积,再计算出二氧化碳的体积分数,从而得出二氧化碳的含量范围,根据计算结果进行判断即可.
解答 解:发生反应方程式为:2CO+02$\frac{\underline{\;点燃\;}}{\;}$2C02,设有VL混合气体,
当CO的体积分数为0.13时,CO有0.13VL,空气为0.87VL,氧气体积为:0.87VL×0.21=0.1827VL
此时氧气过量,则生成0.13VLCO2,反应掉CO 0.13VL、O2 0.065VL,
CO2体积分数为:$\frac{0.13VL}{(1-0.13-0.065+0.13)VL}$=0.139,
当CO的体积分数为0.74时,CO体积为0.74VL,空气体积为0.26VL,氧气体积为:0.26VL×0.21=0.0546VL,
此时氧气不足,则生成二氧化碳体积为:0.0546VL×2=0.1092L,反应掉CO 0.1092VL、O2 0.0546VL,反应后减少的体积为氧气的体积,反应后气体总体积为:VL-0.0546VL=0.9454VL
CO2体积分数为:$\frac{0.1092L}{0.9454L}$≈0.1155;
当CO与氧气恰好完全反应时,二氧化碳的体积分数最大,此时CO体积是氧气体积的2倍,设CO体积为x、则:x+$\frac{0.5x}{0.21}$=VL,x≈0.296L,反应后生成0.296L二氧化碳,氮气的体积为:VL-1.5x=0.556L,所以反应后二氧化碳的体积分数为:$\frac{0.296L}{0.296L+0.556L}$≈0.347;
所以CO2体积分数在0.1155-0.347之间,故BC正确,
故选BC.
点评 本题考查了混合物反应的计算,题目难度中等,明确极值法在化学方程式中的应用为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
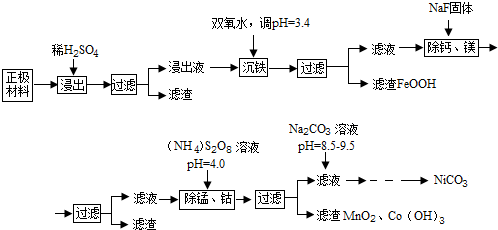
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
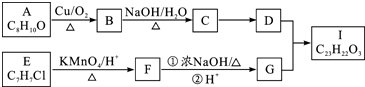
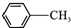 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$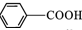

 .
.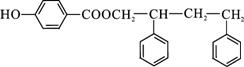 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加人铜粉,铜粉不溶解;再加人NaNO3固体,铜粉仍不溶解 | |
| B. | 向明矾溶液中加人过量NaOH溶液会产生大量白色沉淀 | |
| C. | 除去FeCl3中少量的FeCl2,加人过量稀硝睃 | |
| D. | 浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
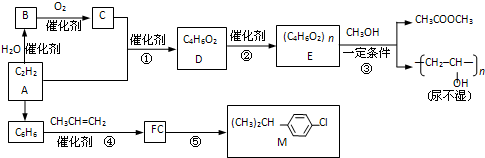
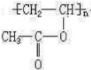 .
.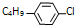 ,则R有4种.
,则R有4种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com