
科目:高中化学 来源: 题型:选择题
| A. | 放电过程中Li+向正极移动 | |
| B. | 可加入硫酸以提高电解质的导电性 | |
| C. | 充电时,Li+向阳极移动 | |
| D. | 放电时,负极反应式为:2Li0.35NiO2+Li++e-═2Li0.85NiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ③④⑥⑦ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V3>V2>V1 | B. | V1>V2=V3 | C. | V3>V2=V1 | D. | V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
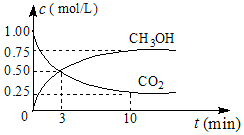 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 若要证明原溶液中是否存在 Cl-,可在第①步的滤液中加硝酸酸化后再加硝酸银溶液 | |
| C. | 加Ba(OH)2溶液中使原溶液中的离子恰好反应且完全沉淀时,混合液呈中性 | |
| D. | 第②步实验中共消耗0.04mol HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
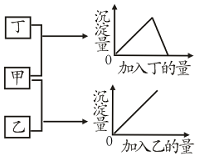 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )| A. | Al2(SO4)3 | B. | NaOH | C. | FeSO4 | D. | BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com