
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、蔗糖都是电解质 | D. | 分馏、干馏都是物理变化 |
分析 A.不同物质组成的为混合物;
B.同种元素组成的不同单质为同素异形体;
C.水溶液中或熔融状态导电的为电解质;
D.分馏是利用物质沸点不同分离混合物,干馏是隔绝空气加强热发生复杂的物理化学变化生成新的物质.
解答 解:A.盐酸是氯化氢的水溶液、漂白粉由氯化钙和次氯酸钙组成,都是混合物,故A正确;
B.127I和131I是碘元素的不同原子互为同位素,故B错误;
C.硫酸铜水溶液中导电属于电解质、蔗糖水溶液中和熔融状态下都不导电,属于非电解质,故C错误;
D.分馏是利用物质沸点不同分离混合物属于物理变化,干馏是隔绝空气加强热发生复杂的物理化学变化生成新的物质,故D错误;
故选A.
点评 本题考查了物质分类、物质组成、物质变化实质、概念实质的应用,掌握基础是解题关键,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
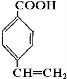 .
.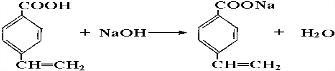 .
.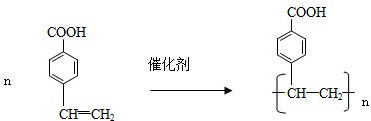 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.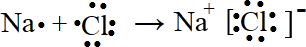 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
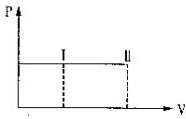 一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.
一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.| A. | 是放热反应 | |
| B. | 反应后气体总分子数增多 | |
| C. | 是吸热反应 | |
| D. | 反应物具有的总能量等于生成物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH,溶液pH升高,c(SO32-)增大 | B. | 氯化钡有两性 | ||
| C. | 两支试管中的白色沉淀都是BaSO4 | D. | SO2具有两性且水溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
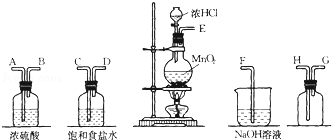
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com