(2011?静安区模拟)大气固氮(闪电时N
2转化为NO)和工业固氮(合成氨)是固氮的重要形式.下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
|
N2+O2?2NO |
N2+3H2?2NH3 |
| 温度 |
25℃ |
2000℃ |
25℃ |
400℃ |
| K |
3.84×10-31 |
0.1 |
5×108 |
200 |
(1)固氮是指
把大气中游离态的氮转化为氮的化合物
把大气中游离态的氮转化为氮的化合物
的过程,自然界固氮的另一途径为
生物固氮
生物固氮
.
(2)根据表中的数据,并结合所学知识分析,下列说法正确的是
a、b
a、b
.
a.人类大规模模拟大气固氮实际意义很小
b.常温下,大气固氮与工业固氮完成程度相差很大
c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行
(3)为研究反应条件的改变对化学平衡移动的影响,将N
2和H
2在一固定体积的密闭容器中进行反应,得到如下的图象.下列有关条件改变(每次只改变一个条件)的说法,正确的是
b、c
b、c
.

a.t
2可能是增加了原料的物质的量
b.t
4可能是充入了He气
c.t
5是从反应体系中分离出氨气
d.t
7时可能是升高温度,使平衡向正反应方向移动
(4)目前工业固氮采用的是哈伯法,即在20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂.俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N
2+3H
2?2NH
3.有关说法正确的是
a、c
a、c
.
a.新法不需要高温条件,可节约大量能源
b.新法能在常温下进行是因为不需要断裂化学键
c.在相同温度下不同的催化剂其催化活性不同.




 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案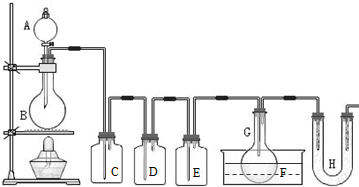 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下: