
分析 (1)As与N同主族位于第VA族,As位于第四周期;其氢化物的结构与氨气相同;
(2)As2O3与锌和硫酸混合发生反应生成砷化氢、硫酸锌和水;As2O3与足量氢氧化钠溶液反应生成亚砷酸钠和水;
(3)根据反应物和生成物来分析反应,则利用氧化还原反应反应中得失电子守恒来分析完全反应的物质的量之比来解答;硫化氢可以用氢氧化钠溶液吸收;
(4)NO3-在正极上得电子生成NO2.
解答 解:(1)As与N同主族位于第VA族,As位于第四周期,即As位于第四周期第VA族;其氢化物的结构与氨气相同,则AsH3分子的空间构型为三角锥形;
故答案为:第四、第VA;三角锥形;
(2)As2O3与锌和硫酸混合发生反应生成砷化氢、硫酸锌和水,其反应的方程式为:As2O3+6H2SO4+6Zn=6ZnSO4+2ASH3↑+3H2O;As2O3与足量氢氧化钠溶液反应生成亚砷酸钠和水,其反应的离子方程式为:As2O3+6OH-=2AsO33-+3H2O;
故答案为:As2O3+6H2SO4+6Zn=6ZnSO4+2ASH3↑+3H2O;As2O3+6OH-=2AsO33-+3H2O;
(3)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,则反应为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S,
根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,则二者的物质的量之比是1:1;硫化氢溶于水显酸性,可以用氢氧化钠溶液吸收;
故答案为:1:1;氢氧化钠溶液;
(4)As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O反应中NO3-得到电子,正极上得电子的物质发生还原反应,所以NO3-在正极上得电子生成NO2,其电极方程式为:NO3-+e-+2H+=NO2↑+H2O;
故答案为:正极;NO3-+e-+2H+=NO2↑+H2O.
点评 本题考查了元素周期表的结构与元素周期律、氧化还原反应、离子方程式的书写、原电池原理的应用,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意掌握氧化还原反应中电子守恒在计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最强 | |
| B. | 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的电离度约为0.4% | |
| D. | 在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
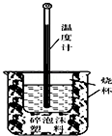 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
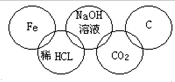 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com