
分析 c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.19g/L×36.5%}{36.5g/mol}$=11.9mol/L,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl还原剂,结合反应的化学方程式计算.
解答 解:反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl还原剂,其中16molHCl参加反应被氧化的HCl为10mol,则还原剂和氧化剂的物质的量之比为10:2=5:1;
c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.19g/L×36.5%}{36.5g/mol}$=11.9mol/L,
n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,由方程式可知,2molKMnO4参加反应,有10molHCl被氧化,则0.1molKMnO4参加反应消耗0.8molHCl,
则至少需要盐酸的体积是V=$\frac{n}{c}$=$\frac{0.8mol}{11.9mol/L}$=0.0672L=67.2mL;
故答案为:5:1;67.2.
点评 本题考查氧化还原反应的计算,把握反应中元素的化合价变化为解答的关键,侧重计算能力、分析能力的考查,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
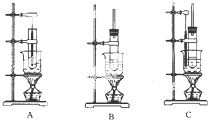 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨
A.有放射性 B易燃、易爆 C能导电 D 有剧毒
有剧毒
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2mol•L-1 | |
| B. | 该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L | |
| C. | 配制50mL 4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com