
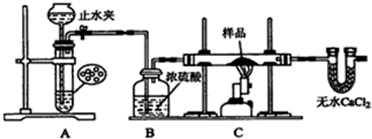
分析 根据图象知,A装置实验目的是制取还原性气体,用的是简易启普发生器制取气体,可以用稀硫酸和Zn制取氢气;B装置作用是干燥气体,C装置用氢气还原红色物质,用无水氯化钙吸收水分;
探究一:
(1)利用压强差检验装置气密性;
(2)打开止水夹生成氢气,通过后续装置充满氢气排出装置中的空气后,检验气体纯度,收集检验氢气纯度,气体纯净后点燃C处的酒精喷灯,反应完成熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化;
(3)氢气不易溶于水,且密度小于空气,可以采用排水法或排空气法收集氢气,但排水法收集氢气较纯净;
探究二:
(4)氧化铁能溶于稀硫酸生成铁离子,铁离子能氧化铜生成铜离子;
铜和浓硝酸反应生成红棕色气体NO2;Fe3+用KSCN溶液检验,二者混合溶液呈血红色;
探究三:
(5)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,结合化学方程式定量关系计算得到.
解答 解:根据图象知,A装置实验目的是制取还原性气体,用的是简易启普发生器制取气体,可以用稀硫酸和Zn制取氢气;B装置作用是干燥气体,C装置用氢气还原红色物质,用无水氯化钙吸收水分;
(1)利用压强差检验装置气密性,其检验方法为:向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变,则该装置气密性良好,
故答案为:向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变;
(2)氢气混有空气加热发生爆炸,所以开始先通氢气,打开止水夹生成氢气,通过后续装置充满氢气,目的是排出装置中的空气,检验最后U型管出来的气体氢气纯度,气体纯净后再点燃C处的酒精喷灯,反应完成后先撤酒精灯,玻璃管冷却再停氢气,操作位熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化,所以其排列顺序是①⑥⑤④②③;
故答案为:①⑥⑤④②③;
(3)氢气不易溶于水,且密度小于空气,可以采用排水法或排空气法收集氢气,但排水法收集氢气较纯净,故答案为:排水;
(4)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O,此观点不正确,原因是生成的铜和铁离子发生氧化还原反应,离子方程式为2Fe3++Cu=2Fe2++Cu2+;
另取少量样品于试管中,加入适量的浓硝酸,Cu和浓硝酸发生氧化还原反应生成红棕色气体二氧化氮,所以看到的现象是产生红棕色气体,证明样品中一定含有Cu2O;
反应后的溶液中含有Fe2+、Cu2+,可能含有Fe3+,取少量反应后的溶液,加适量蒸馏水稀释后,滴加KSCN溶液,铁离子和KSCN溶液混合产生血红色,滴加KSCN溶液后溶液呈血红色,则可证明另一成分存在,反之,说明样品中不含该成分,
故答案为:否;2Fe3++Cu=2 Fe2++Cu2+;红棕色的气体;Cu2O;KSCN溶液;若溶液变血红色;
(5)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,生成1.0molFe2+,消耗Cu0.5mol,剩余Cu物质的量=$\frac{3.2g}{64g/mol}$=0.05mol,原样品中Cu2O物质的量=0.05mol+0.5mol=0.55mol,
故答案为:0.55.
点评 本题考查物质成分检验,为高频考点,涉及方程式的计算、离子检验、实验操作先后顺序等知识点,明确实验原理及物质性质、实验操作方法等知识点是解本题关键,注意离子检验操作方法、实验现象,题目难度中等.


科目:高中化学 来源: 题型:实验题
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
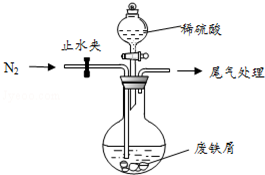 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经气化或液化这两个化学变化过程都可以转变为清洁能源 | |
| B. | 石油裂解目的是提高汽油的质量和产量 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com