
【题目】下列说法不正确的是( )
A.钾的金属性比钠强
B.溴的非金属性比氯强
C.ⅦA族中原子半径最小的是氟
D.第三周期中,除稀有气体元素外原子半径最大的是钠
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排酸性废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
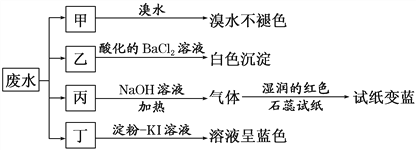
已知:废水试样中除H+外可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________________(填化学式,下同),离子Y是________________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为____________________________________________________________________________。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式: _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于第三周期第ⅣA族.下列叙述不正确的是( )
A.该元素是金属元素
B.该元素原子的核电荷数为14
C.该元素原子核外有3个电子层
D.该元素原子不容易得到或者失去最外层电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(1)实验①得出的结论__________________________________________。
(2)指出实验②和实验④中的“实验现象”:②_____________;④____________。
(3)实验③中“实验方法”的具体操作过程是:___________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a_____________,b._________。请设计简单的实验证明哪一个是正确的_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
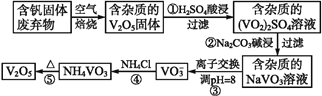
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。
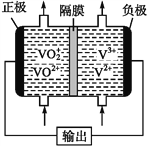
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法正确的是
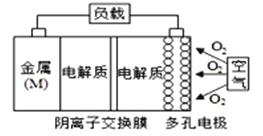
A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. M-空气电也放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
C. Al作电极材料时电解质溶液最好选酸性,这样更有利于反应的发生,同时防止负极区沉淀
D. 在Mg-空气电也中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
![]()
下列说法正确的是
A. 若HnCOm为强酸,则D元素肯定是活泼的非金属元素
B. 若A(OH)n为强碱,则B(OH)m也一定为强碱
C. 若C的最高正化合价为+5价,则五种元素均为非金属元素
D. 若D的最低负化合价为-2价,则E的最高正价为+6价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol的镁、铝混合物溶于200mL4mol/LHCl溶液中,然后再滴加2mol/LNaOH溶液。
(1) 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=______mol,V2=______mL。
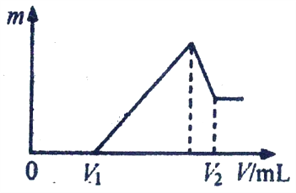
(2) 若在滴加NaOH 溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=______mL。
(3) 若混合物仍为0.2mol。其中Mg粉的物质的量分数为a,用200mL4mol/LHCl溶解此混合物后,再加入450mL2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com