
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)I3﹣(aq)某I2、KI混合溶液中,I3﹣的物质的量浓度c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )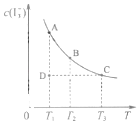
A.反应 I2(aq)+I﹣(aq)I3﹣(aq)△H>0
B.状态A与状态B相比,状态A的c(I2)大
C.若反应进行到状态D时,一定有v逆>v正
D.若温度为T1、T2 , 反应的平衡常数K1、K2则 K1>K2
【答案】D
【解析】A.由图象曲线的变化趋势可知,当温度升高时,I3﹣的物质的量浓度减小,说明该反应的正反应为放热反应,反应I2(aq)+I﹣(aq)I3﹣(aq)的△H<0,A不符合题意;
B.温度升高,平衡向逆方向移动,c(I3﹣)变小,则c(I2)应变大,所以状态B的c(I2)大,B不符合题意;
C.若反应进行到状态D时,反应未达到平衡状态,若反应趋向于平衡,则反应向生成的I3﹣方向移动,则v正>v逆,C不符合题意;
D.该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,温度越高,平衡常数越小,若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2,D符合题意.
故答案为:D.
由图当温度升高时,I3﹣的物质的量浓度减小,判断该反应的正反应为放热反应;升高温度,平衡向逆反应方向移动,平衡常数变小,根据温度对平衡移动的影响分别判断碘单质的转化率、平衡常数的变化、反应进行方向及不同状态的A的浓度大小,以此解答.


科目:高中化学 来源: 题型:
【题目】空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
(1)上述3种气体直接排入空气后会引起酸雨的气体有(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 该反应的平衡常数K的表达式为;
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式 , 当标况下有4.48L被处理时,通过电极B的电子数为 . 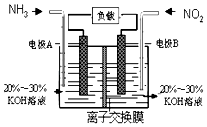
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
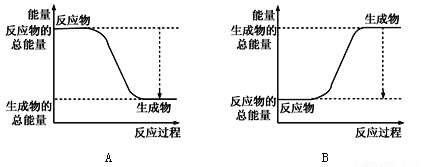
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及实验方案的设计不正确的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
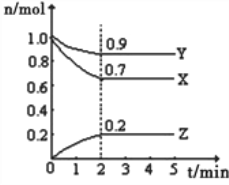
(1)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(2)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。
2HI(g)达到平衡状态的是 _________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
Ⅲ.(1)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4, 铅蓄电池放电时,_______(填物质名称)做负极。放电过程中硫酸浓度由5mol/L 下降到 4mol/L,电解液体积为 2L(反应过程溶液体积变化忽略不计),求放电过程中外电路中转移电子的物质的量为___________mol。
Pb + PbO2 + 2H2SO4, 铅蓄电池放电时,_______(填物质名称)做负极。放电过程中硫酸浓度由5mol/L 下降到 4mol/L,电解液体积为 2L(反应过程溶液体积变化忽略不计),求放电过程中外电路中转移电子的物质的量为___________mol。
(2)有人设计将两根 Pt 丝作电极插入 KOH 溶液中,然后向两极上分别通入乙醇和氧气而 构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:_____________
正极:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·nH2O)在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。请回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化;再向试管中通入空气,溶液逐渐变红。请解释变红的原因________________________。
(2)为测定某绿矾中结晶水含量,按下图组装好仪器并检查气密性。将石英玻璃管(带两端开关K1和K2)(设整个为装置A)称重,记为80.120g。将样品装入石英玻璃管中,再次将装置A称重,记为 107.020g。按下图连接好装置进行实验。
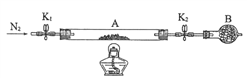
①仪器B的名称是____________________。
②实验操作步骤为: 第一步: 打开K1和K2,缓缓通入N2 ; 第二步:点燃酒精灯,小心加热;第三步:熄灭酒精灯 ;第四步:冷却到室温 ; 第五步:关闭K1和K2 ; 第六步:称量A 。 请问: 第一步缓缓通入N2 的目的是________________________。
重复上述操作步骤,直至A恒重,记为95.320g。
③计算绿矾化学式中结晶水n=________________(保留一位小数)。
(3)同学们查找资料可知,硫酸亚铁在高温下分解产物为Fe2O3 以及 SO2和SO3。为了验证硫酸亚铁分解的气体产物,将已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加强热充分反应后,管中残留固体为 _______ 色粉末。![]()
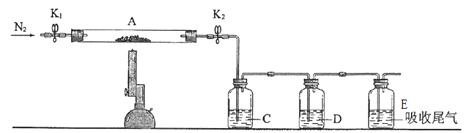
C、D中的溶液依次为________ 、________(填标号)。
a.品红 b.NaOH c.BaCl2 d.浓硫酸
(4)“严谨不仅仅是一种生活态度,更是科学精神”。检查装置气密性是化学实验中的重要操作之一,在上述32题实验装置气密性检查的操作是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中化学键的类型完全相同的是( )
A.NaCl MgCl2 Na2O
B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4
D.NH4Cl H2O CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香烟烟雾中往往含有CO和SO2气体,下列关于这两种气体的说法正确的是( )
A.两者都易溶于水
B.两者都污染环境,危害健康
C.两者都能使品红溶液褪色
D.两者都是形成酸雨的主要原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com