
| A. | NaOH | B. | NH4Cl | C. | NaCl | D. | H2SO4 |
科目:高中化学 来源: 题型:多选题
| A. | 鲜榨橙汁遇到碘水会变蓝 | B. | 馒头越嚼越甜 | ||
| C. | 油脂经碱性水解可制得肥皂 | D. | 土豆中的淀粉经水解可变成酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3(g)所具有的能量 | |
| B. | 将2molSO2(g)和O2(g)置于某密闭容器中充分反应,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向正反应方向移动 | |
| D. | 若将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程有2molSO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 一定条件下,Z单质与W的常见单质直接生成ZW | |
| B. | X最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物能反应 | |
| C. | Y的最高价氧化物对应的水化物不能溶于稀氨水 | |
| D. | 一定条件下,w单质可以将z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$\stackrel{SO_{2}}{→}$HClO | |
| B. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3 | |
| C. | SO2$\stackrel{NH_{3}•H_{2}O}{→}$NH4HSO3$?_{SO_{2}H_{2}O}^{NH_{3}H_{2}O}$(NH4)2SO3 | |
| D. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al,Al-3e-=Al3+ | B. | Cu,Cu-2e-=Cu2+ | ||
| C. | Al,2H++2e-=H2↑ | D. | Cu,2H++NO3-+e-=NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含硫原子的物质的量之比为1:1 | B. | 氧原子的物质的量之比为3:2 | ||
| C. | 氧元素的质量比为2:3 | D. | 硫元素的质量比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
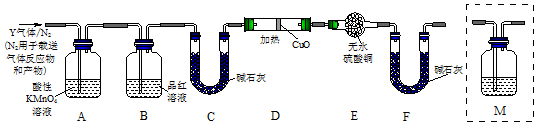
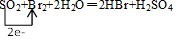 ,
,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com