
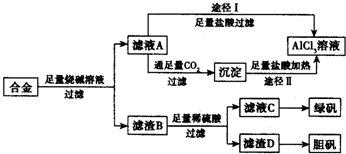
 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:分析 流程题的关键是明确流程中每一步的反应过程,前后连贯综合考虑解答问题,铝、铁、铜的合金中加入足量烧碱溶液过滤,得到滤液A为偏铝酸钠溶液,滤渣B为铁和铜,由滤液A加入足量盐酸反应制取AlCl3溶液,同时A中含有Na+,该途径是不行的,制取的AlCl3中含有杂质;滤液A中通入足量二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到沉淀中加入足量盐酸加热通过途径Ⅱ得到氯化铝溶液;滤渣B中加入足量硫酸溶液铁反应生成硫酸亚铁溶液,铜不反应,过滤得到滤液C为硫酸亚铁溶液,从滤液C中获得绿矾晶体注意的是冷却结晶,不是蒸发结晶,滤渣D为铜,通过氧化生成氧化铜,氧化铜和硫酸反应生成硫酸铜溶液,浓缩蒸发,冷却结晶,过滤洗涤得到胆矾,
(1)合金溶于足量烧碱溶液时发生反应生成偏铝酸钠和氢气,途径I中是过量氢氧化钠和盐酸发生反应生成氯化钠和水,偏铝酸钠溶液和盐酸反应得到氯化铝、氯化钠的混合溶液;
(2)由滤液A得AlCl3溶液的途径有I和II两种,分析可知由滤液A加入足量盐酸反应制取AlCl3溶液,同时A中含有Na+,该途径Ⅰ是不行的,途径Ⅱ可以得到氯化铝溶液,
(3)在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,铜和过氧化氢扎起稀硫酸溶液中发生氧化还原反应生成硫酸铜溶液,结合反应的定量关系计算得到需要氧化剂过氧化氢的物质的量;
(4)利用溶液中溶质分离的方法回答,硫酸亚铁溶液蒸发浓缩,冷却结晶,过滤洗涤得到晶体.
解答 解:(1)合金溶于足量烧碱溶液时发生反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,途径I中是过量氢氧化钠和盐酸发生反应生成氯化钠和水,反应的离子方程式为:H++OH-═H2O,偏铝酸钠溶液和盐酸反应得到氯化铝、氯化钠的混合溶液,反应的离子方程式为:AlO2-+4H+═Al3++2H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+4H+═Al3++2H2O、H++OH-═H2O;
(2)滤液A为偏铝酸钠溶液,滤渣B为铁和铜,由滤液A加入足量盐酸反应制取AlCl3溶液,同时A中含有Na+,该途径是不行的,制取的AlCl3中含有杂质;滤液A中通入足量二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到沉淀中加入足量盐酸加热通过途径Ⅱ得到氯化铝溶液,途径Ⅱ更合理,因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入CO2气体,得Al(OH)3 沉淀,将Al(OH)3溶解于盐酸中得到的是较纯净的AlCl3溶液;
故答案为:Ⅱ;因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入CO2气体,得Al(OH)3 沉淀,将Al(OH)3溶解于盐酸中得到的是较纯净的AlCl3溶液;
(3)H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体,稀硫酸和H2O2溶解滤渣D的离子方程式为:Cu+H2O2+2H+═Cu2++2H2O,制取500g胆矾物质的量=$\frac{500g}{250g/mol}$=2mol,需要的氧化剂过氧化氢的物质的量为2mol,
故答案为:Cu+H2O2+2H+═Cu2++2H2O;2mol;
(4)从滤液C中获得绿矾晶体,硫酸亚铁溶液蒸发浓缩,冷却结晶,过滤洗涤得到晶体,故答案为:蒸发、浓缩、冷却结晶.
点评 本题考查了物质性质的分析,流程分析判断,主要是物质性质转化的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备苯乙酮的化学方程式为:
实验室制备苯乙酮的化学方程式为: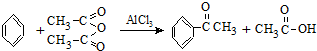
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
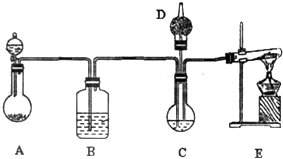 纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.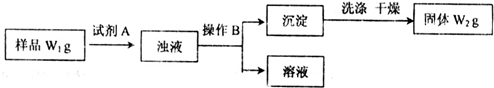
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com