
| A. | 甲苯和水 | B. | 溴乙烷和水 | C. | 油酯和水 | D. | 乙醛和水 |
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醇 | B. | 1-丙醇 | C. | 丙酸 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③① | B. | ②③① | C. | ②④③⑤① | D. | ②⑤③① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | 稀盐酸、BaCl2溶液 | ||
| C. | 稀硝酸、BaCl2溶液 | D. | 稀硫酸、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
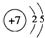 .
.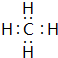 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com