
分析 乙酸为弱酸,存在电离平衡,Ka只与温度有关,电离为吸热反应,稀释促进电离,结合电离平衡移动来解答.
解答 解:醋酸分子式为CH3COOH,是一种弱电解质其在水溶液中电离的方程式为:CH3COOH?CH3COO-+H+,在这个条件下,该电离方程式的电离平衡常数K表达式为:Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,若升高温度,电离平衡常数会增大,若往已经达到平衡的水溶液中加入少量的固体CH3COONa,醋酸根离子浓度增大,则电离平衡会向左移动,若将该溶液进行稀释,电离平衡常数不变,平衡向右移动,
故答案为:弱;CH3COOH?CH3COO-+H+;Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$;增大;左;不变;右.
点评 本题考查弱电解质的电离平衡,为高频考点,把握电离平衡移动、电离平衡常数等为解答的关键,侧重分析与应用能力的考查,注意Ka只与温度有关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cs与U的质子数差值为37 | B. | Cs与U的中子数差值为98 | ||
| C. | 铯137的电子数是82 | D. | 铀元素的相对原子质量是235 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 1molFeI2与足量氯气反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
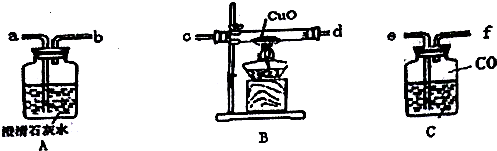
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
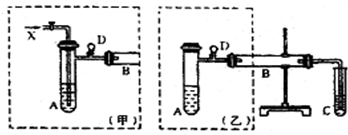

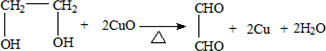 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn粉中含少量的ZnO:加入足量稀H2SO4充分反应后过滤 | |
| B. | Cu(NO3)2溶液中含少量AgNO3:加入足量Cu屑充分反应后过滤 | |
| C. | Na2SO4溶液中含少量H2SO4:加入足量Ba(OH)2充分反应后过滤 | |
| D. | CaCO3固体中含少量Na2CO3:加入足量稀HCl充分反应后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗 | |
| B. | 医用酒精的质量分数为75% | |
| C. | 冬天汽车所用的防冻液主要成分为丙三醇 | |
| D. | 福尔马林是35%~40%的甲醛水溶液,可用于浸制生物标本 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com