
【题目】示踪原子法是研究化学反应的重要方法之一,下列化学方程式正确的是
A. 2Na2O2+2H218O= 4NaOH+18O2 ↑
B. 2KMnO4+5H218O +3H2SO4= K2SO4+2MnSO4+ 518O2↑+8H2O
C. CH3C18OOH + CH3OH![]() CH3CO18OCH3+H2O
CH3CO18OCH3+H2O
D. 6H37Cl+ NaClO3==NaCl+37Cl2+3H2O
【答案】B
【解析】A、氧气中的氧来源于过氧化钠:2Na2O2+2H218O= 2Na18OH+O2 ↑+2NaOH,故A错误;B、2KMnO4+5H218O2 +3H2SO4= K2SO4+2MnSO4+ 518O2↑+8H2O,过氧化氢跟酸性高锰酸钾溶液反应,过氧化氢中的-1的O被氧化,生成0价的氧气,故B正确;C、在浓硫酸存在条件下与足量乙酸充分反应,化学方程式为:CH3C18OOH + CH3OH![]() CH3C18OOCH3+H2O,故C错误;D、氯酸钠跟浓盐酸混合,氯酸钠中的氯被还原,生成氯气,即37Cl应在氯气中,反应为 6H37Cl+ NaClO3==Na37Cl+3Cl2(537Cl-Cl)+3H2O,故D错误;故选B。
CH3C18OOCH3+H2O,故C错误;D、氯酸钠跟浓盐酸混合,氯酸钠中的氯被还原,生成氯气,即37Cl应在氯气中,反应为 6H37Cl+ NaClO3==Na37Cl+3Cl2(537Cl-Cl)+3H2O,故D错误;故选B。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是( )
A. NaHCO3水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4= Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。实验装置:
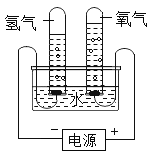
部分实验数据:
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是__________mol、___________mol。
(2)该温度下,气体摩尔体积是________________。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是___________mL。
(4)根据以上实验得出如下结论,其中不正确的是_________________。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

(1) A的名称为____;C分子中的官能团名称为_________。
(2)反应③的化学方程式为_________;该反应的反应类型为_________。
(3)反应④的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
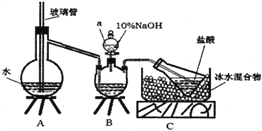
步骤二,氯的测定:准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是________;装置B中仪器a的名称为_________。
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为_________g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将_______(填“偏高”、“偏低”或“无影响”);冰水混合物的作用是___________。
(5)测定氯的过程中,使用棕色滴定管的原因是_________;出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×10-12Ksp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在。制备M的化学方程式为_____________________,其中双氧水的作用是__________;制备M的过程中温度不能过高的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后会变质失效
C.漂白粉的有效成分Ca(ClO)2不稳定,易分解
D.在使用漂白粉时要加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )

A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.棕色集气瓶中装有Cl2和O2,可用观察颜色的方法把它们区别开来
B.棕色集气瓶中装有Cl2和O2,可用加水的方法把它们区别开来
C.某混合气体若为无色气体,则混合气体中肯定不含大量Cl2
D.某混合气体若为无色气体,则混合气体中肯定不含大量O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com