
分析 (1)根据公式n=$\frac{N}{{N}_{A}}$进行计算;
(2)根据公式N=nNA=$\frac{m}{M}$NA进行计算;
(3)根据n=$\frac{m}{M}$计算出氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算出水配制的氢氧化钠溶液的浓度,然后根据溶液具有均一性可知取出的10mL氢氧化钠的溶液的浓度;
(4)一定温度与压强下,气体的体积之比等于物质的量之比,等于化学计量数之比,然后利用质量守恒定律来确定化学式.
(5)先分别利用n=cV来计算溶液中溶质的物质的量,从而确定Cl-的物质的量,最后利用c=$\frac{n}{V}$来计算混合液中Cl-的物质的量浓度.
(6)溶液中阴离子和阳离子的正负电荷守恒,根据守恒思想来计算.
解答 解:(1)6.02×1023个氧原子,即氧原子的物质的量是1mol,所以H2SO4的物质的量是:1mol×$\frac{1}{4}$=0.25mol,
故答案为:0.25mol;
(2)标准状况下VL CO2所含氧原子数目是:$\frac{VL}{22.4L/mol}$×2=$\frac{V}{11.2}$mol,含有氧原子说明相同,则含有氧原子的物质的量相等,则水的物质的量为
$\frac{V}{11.2}$mol,水的质量为:18g/mol×$\frac{V}{11.2}$mol≈1.61Vg,
故答案为:1.61V;
(3)将4g NaOH溶解在10mL水中,再稀释成1L,4g氢氧化钠的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,稀释后溶液浓度为:$\frac{0.1mol}{1L}$=0.1mol/L,从中取出10mL,由于溶液具有均一性,则这10mL溶液的物质的量浓度不变,仍然为0.1mol/L,
故答案为:0.1mol/L;
(4)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,
则X2+3Y2═2Z,由原子守恒可知,Z为XY3,
故答案为:XY3;
(5)NaCl的物质的量为:0.05L×0.1mol/L=0.005mol,CaCl2的物质的量为:0.05L×0.5mol/L=0.025mol,则混合液中Cl-的总物质的量为:0.005mol+0.025mol×2=0.055mol,所以混合液中Cl-的物质的量浓度为:$\frac{0.055mol}{0.05L+0.05L}$=0.55mol/L,
故答案为:0.55mol/L;
(6)溶液中阴离子和阳离子的正负电荷守恒,即n(Na+)+2n( Mg2+)=n (Cl-)+2n(SO42-),所以0.2 mol+2×0.25 mol=0.4 mol+2n(SO42-),解出n(SO42-)=0.15mol,
故答案为:0.15mol.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数等之间的关系即可解答,试题知识点较多,充分考查了学生分析能力及化学计量能力.


科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
科学家 用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级的是 ( )
用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级的是 ( )
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
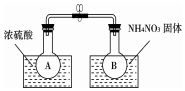 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.9g/mol | B. | 26 | C. | 26 g/mol | D. | 29.3 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
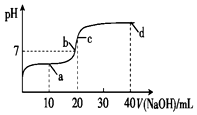 室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )
室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )| A. | a点:c(HA)>c(A-) | B. | b点:c(Na+)=c(A-)+c(HA) | ||
| C. | c点:c(H+)+c(HA)=c(OH-) | D. | d点:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能被银氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol该有机物只能与1molBr2发生加成反应 | |
| D. | 1mol该有机物只能与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
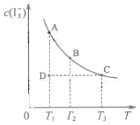 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )| A. | 反应 I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A与状态B相比,状态A的c(I2)大 | |
| C. | 若反应进行到状态D时,一定有v逆>v正 | |
| D. | 若温度为T1、T2,反应的平衡常数K1、K2则 K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均减半 | B. | 均加倍 | C. | 均减少1mol | D. | 均增加1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com