
分析 令Na、Mg、Al的质量都为1g,根据n=$\frac{m}{M}$计算Na、Mg、Al的物质的量,金属提供电子的物质的量之比等于生成氢气的质量之比.
解答 解:令Na、Mg、Al的质量都为1g,则:
1gNa的物质的量为$\frac{1g}{23g/mol}$=$\frac{1}{23}$mol,1gNa提供电子物质的量为$\frac{1}{23}$mol×1=$\frac{1}{23}$mol,
1gMg的物质的量为$\frac{1g}{24g/mol}$=$\frac{1}{24}$mol,1gMg提供电子物质的量为$\frac{1}{24}$mol×2=$\frac{1}{12}$mol,
1gAl的物质的量为$\frac{1g}{27g/mol}$=$\frac{1}{27}$mol,1gAl提供电子物质的量为$\frac{1}{27}$mol×3=$\frac{1}{9}$mol,
金属提供电子的物质的量之比等于生成氢气的质量之比,即生成氢气质量之比为$\frac{1}{23}$mol:$\frac{1}{12}$mol:$\frac{1}{9}$mol=36:69:92,
故答案为:36:69:92.
点评 本题考查化学方程式有关计算,难度不大,注意利用电子转移守恒计算解答.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C3H4O2 | B. | C4H10O5 | C. | C5H10O4 | D. | C5H8O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4 既不是氧化剂又不是还原剂 | |
| D. | 1mol KCl参加反应时有5mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)等于c(CO32-)与c(HCO3-)之和 | B. | c(HCO3-) 等于c(CO32-) | ||
| C. | c(HCO3-) 略大于c(CO32-) | D. | c(HCO3-) 略小于c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
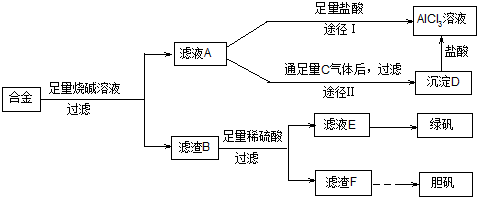
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚具有弱酸性,但不能使紫色石蕊变红 | |
| B. | 能因发生化学反应而使溴水褪色的物质一定是和溴水发生加成反应 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 含醛基的有机物都能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com