
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
|
| A. | NF3是氧化剂,H2O是还原剂 |
|
| B. | NF3在潮湿空气中泄漏会看到红棕色气体 |
|
| C. | 每消耗0.2mol氧化剂,可收集到5.418L气体 |
|
| D. | 若生成1molHNO3,则转移NA个电子 |
| 氧化还原反应. | |
| 分析: | 反应3NF3+5H2O=2NO+HNO3+9HF中只有N元素化合价发生变化,NF3既是氧化剂又是还原剂,生成的NO易被氧化生成NO2,结合化合价的变化判断电子转移的数目. |
| 解答: | 解:A.反应3NF3+5H2O→2NO+HNO3+9HF中只有N元素化合价发生变化,NF3既是氧化剂又是还原剂,故A错误; B.NF3生成的NO易被氧化生成NO2,所以在潮湿空气中泄漏可观察到红棕色气体,故B正确; C.0.3molNF3参加反应,有0.2mol化合价降低,为氧化剂,生成2molNO,在标准状况下为4.48L,故C错误; D.3molNF3生成1molHNO3,化合价由+3价升高到+5价,则转移2mol电子,数目为2NA,故D错误. 故选B. |
| 点评: | 本题考查氧化还原反应,题目难度中等,注意分析元素化合价的变化,为解答该题的关键,根据元素化合价的变化判断电子转移的数目,结合方程式计算. |


科目:高中化学 来源: 题型:
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
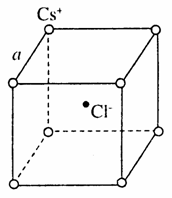
A.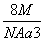 g· cm-3 B.
g· cm-3 B.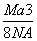 g· cm-3
g· cm-3
C.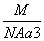 g· cm-3 D.
g· cm-3 D.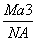 g· cm-3
g· cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
在物质的量浓度均为0.01mol·L-1的CH3COOH和CH3COONa的混合溶液中,测得c(CH3COO-)>c(Na+),则下列关系式正确的是( )
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
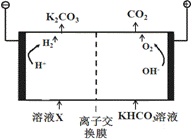
在阳极区发生的反应包括 和H ++ HCO3- == H2O + CO2↑。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) + 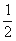 O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
CH3OH(g) +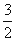 O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
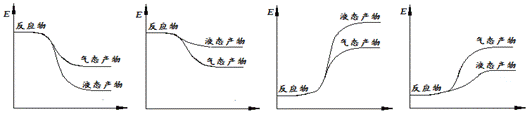
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
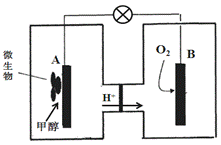
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
|
| A. | 1:4 | B. | 1:2 | C. | 2:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是( )
|
| A. | NaN3中氮元素的化合价为﹣3 |
|
| B. | 氧化剂和还原剂是同一物质 |
|
| C. | 反应过程中若转移1mol电子,则产生2.24L气体(标准状况) |
|
| D. | 被氧化的氮原子与生成的氮气分子个数之比为15:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
20g烧碱配制成 500mL溶液,其物质的量浓度为 mol•L﹣1;从中取出1mL,其中含溶质为 g.若将这1mL溶液用水稀释到100mL,所得溶液中含Na+ g.
查看答案和解析>>
科目:高中化学 来源: 题型:
格林尼亚试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,如CH3CH2Br+Mg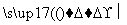 CH3CH2MgBr,它可与羰基发生加成反应,其中的“—MgBr”部分加到羰基的氧上,所得产物经水解可得醇。今欲通过上述反应合成2丙醇,选用的有机原料正确的一组是( )
CH3CH2MgBr,它可与羰基发生加成反应,其中的“—MgBr”部分加到羰基的氧上,所得产物经水解可得醇。今欲通过上述反应合成2丙醇,选用的有机原料正确的一组是( )
A.氯乙烷和甲醛 B.氯乙烷和丙醛
C.一氯甲烷和丙酮 D.一氯甲烷和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
用铂电极电解氢氧化钠溶液,测定两极逸出气体的体积,记录如下表:
| 时间/min 气体体积/mL | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 阴极生成的气体 | 6 | 12 | 20 | 29 | 39 | 49 | 59 | |
| 阳极生成的气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 |
(1)完成有关的电极反应式:阴极_______________________,
阳极______________________。
(2)完成电解池总反应方程式__________________________。
(3)开始电解阶段两极产生气体的体积比不符合理论比值的原因是______________________________________。
(4)自第______________分钟起阴极与阳极产生气体的体积比符合理论的比值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com