
| ||
| ||
| 11 |
| 4 |
| 11 |
| 4 |
| V |
| Vm |
| 1×103L×0.5% |
| 22.4L/mol |
| n |
| V |
| 0.1536mol |
| 0.05L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| R | ||
| X | T | Z |
| Q |
| A、非金属性:Z<T<X |
| B、R与Q的电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同 |
| D、由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
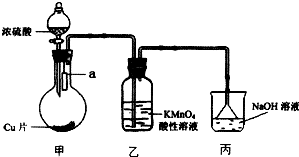 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.查看答案和解析>>
科目:高中化学 来源: 题型:
 煅烧过程存在以下反应:
煅烧过程存在以下反应:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
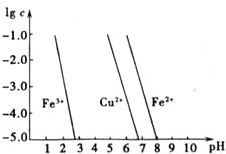 如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:
如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
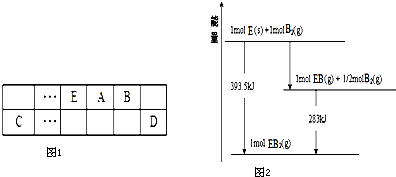
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、必须根据其中三个反应才可得出结论 |
| D、K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com