
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂(1)盐酸、(2)Na2CO3、(3)NaOH、(4)BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯的操作步骤和加入试剂的情况如图1:

图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)生成沉淀A的化学方程式___________________________________;
(2)试剂d是________;判断试剂d已经足量的简单方法_______________________________;如果在加入d试剂前没有过滤,引起的后果是___________________________________。
(3)沉淀B、C、D的化学式分别为(不讲顺序)__________,_____________,____________;
(4)现有如图2仪器,过滤出沉淀A、B、C、D时必须用到______________(填序号)。

Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的_______________________(填序号);实验时②中除加入适量海水外,还需加入_____,其作用是_________________________。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述中的仪器,该仪器名称为____________。为了使该仪器中液体可以顺利流下,应进行的具体操作是__________。向该碘水中加入四氯化碳以提取碘单质的实验操作为___________________。
【答案】MgSO4+BaCl2 =BaSO4↓+MgCl2盐酸(HCl)溶液中不再产生气体生成的沉淀溶与酸反应,并不能除去杂质离子(答案意思相近即可)CaCO3BaCO3Mg(OH)2④②③⑤⑥沸石(碎瓷片)防止暴沸分液漏斗打开分液漏斗上端活塞或使凹孔对准小孔萃取(分液)
【解析】
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都行;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀;但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,使离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子。
(1).用(1)盐酸; (2)Na2CO3、(3)NaOH、(4)BaCl24种试剂来除去食盐水中Ca2+、Mg2+、SO42-离子,结合上面分析,加入试剂的顺序是(4)(3)(2)(1)。氯化钡可以将硫酸根离子沉淀,反应的化学方程式为MgSO4+BaCl2 =BaSO4↓+MgCl2:,因此,本题答案是MgSO4+BaCl2 =BaSO4↓+MgCl2。
(2)试剂d是盐酸,盐酸可以和碳酸根离子之间反应生成水和二氧化碳,当不再产生二氧化碳时,证明盐酸已经过量。因为生成的沉淀为CaCO3、BaCO3、Mg(OH)2,d试剂为盐酸,如果在加入d试剂之前前没有过滤,引起的后果是生成的沉淀溶与盐酸反应,达不到除去杂质离子的目的。因此,本题答案是:盐酸;溶液中不会再产生气体,生成的沉淀溶与盐酸反应,并不能除去杂质离子。
(3)滤液中加稍过量的氢氧化钠,把镁离子生成氢氧化镁沉淀,加入稍过量碳酸钠,钙离子及过量的钡离子生成碳酸钙、碳酸钡沉淀,故沉淀B、C、D分别为碳酸钙、碳酸钡、氢氧化镁沉淀。因此,本题答案是: CaCO3 、BaCO3 、Mg(OH)2;
(4)过滤实验用到的仪器:漏斗、玻璃棒、烧杯等,根据实验装置,过滤出沉淀A、B、C、D时必须用到漏斗,因此,本题正确答案是:(4);
Ⅱ、蒸馏装置需要的仪器有:酒精灯、蒸馏烧瓶、单孔塞、冷凝管、牛角管、锥形瓶, 实验时②中除加入适量海水外,还需加入沸石(碎瓷片),其作用是防止暴沸。因此,本题答案是:(2)(3)(5)(6); 沸石(碎瓷片)防止暴沸。
Ⅲ、从碘水中提取碘,可以采取萃取分液操作,使用的萃取剂是四氯化碳,使用的仪器是分液漏斗,为了使该仪器中液体可以顺利流下,应进行的具体操作是打开分液漏斗上端活塞或使凹孔对准小孔。答案:分液漏斗、打开分液漏斗上端活塞或使凹孔对准小孔、萃取(分液)


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 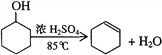
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
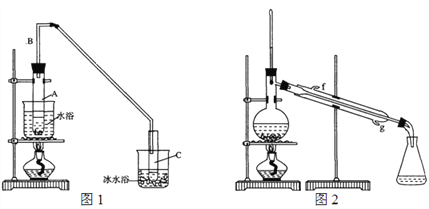
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2] 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. H+进过质子交换膜由右向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
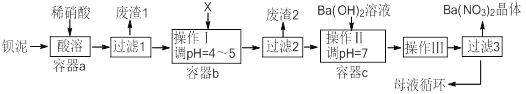
【题目】钡盐生产过程中排出大量钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:
已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大,在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理 。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为 。
(3)结合本厂生产实际,X试剂应选下列中的 。
A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为 。
(5)操作III为 。
(6)过滤III后的母液应循环到容器 中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料在一定条件下可转化为乙烯基乙炔(CH≡C—CH=CH2)。下列关于乙烯基乙炔分子的说法错误的是( )
A. 能使酸性KMnO4溶液褪色
B. 1 mol乙烯基乙炔能与3 mol Br2发生加成反应
C. 乙烯基乙炔分子中含有两种官能团
D. 等质量的乙炔与乙烯基乙炔完全燃烧时耗氧量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图, 下列说法错误的是
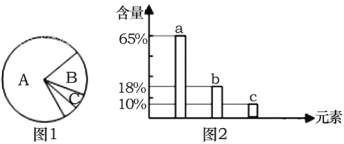
A. 若图1表示正常细胞的化合物含量,则化合物A、B共有的元素中含量最多的是图2中 的a
B. 若图1表示细胞完全脱水后的化合物含量,则化合物A中含量最多的元素为图2中的 b
C. 若图1表示正常细胞的化合物含量,则化合物B具有多样性,其必含的元素为C、H、O、N
D. 图2中数量最多的元素是碳,这与细胞中含量最多的化合物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.氢氧化钠与盐酸反应:OH﹣+H+═H2O
C.锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu
D.氯化钡溶液与稀硫酸反应:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com