
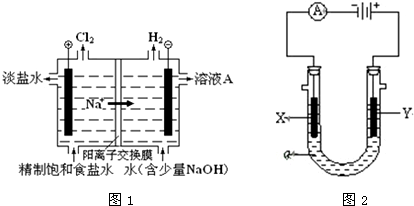
分析 (1)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,据此书写离子;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠;
(2)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极X电极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,滴加酚酞,溶液变红;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,氯气具有氧化性,可以用湿润的碘化钾淀粉试纸检验;
(3)电解方法精炼粗铜,电解液是含有铜离子的盐溶液,阴极的材料是纯铜,阳极材料是粗铜,据此回答.
解答 解:(1)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,所以电池反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,电解饱和食盐水的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,即溶液A是氢氧化钠浓溶液;故答案为:氢氧化钠浓溶液;
(2)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极X电极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,滴加酚酞,所以X极溶液变红,故答案为:X;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,电极反应为:2Cl--2e-=Cl2↑,氯气的检验方法:把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色,故答案为:2Cl--2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
(3)电解方法精炼粗铜,电解液是含有铜离子的盐溶液,如CuSO4溶液,则阴极的材料是纯铜,阳极材料是粗铜,在阴极区域发生反应:Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu.
点评 本题考查了电解原理、气体的检验等知识点,明确离子放电顺序是解本题关键,氯气可以用淀粉碘化钾检验,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1 | B. | l mol•L-1 | C. | 2 mol•L-1 | D. | 3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: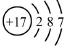 | |
| C. | 氯分子的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4•5H20溶于100 mL蒸馏水中 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的浓溶液,冷却结晶,过滤、洗涤 |
| C | 检验某溶液中是否含硫酸根 | 向溶液中先加盐酸后加氯化钡 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A. | 反应开始时,反应速率:甲<乙<丙 | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,c(CO2)丙=2c(CO2)甲 | |
| D. | 平衡时,乙中CO2的体积分数大于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的族序数是周期序数的三倍 |
| Z元素的电负性在所有元素中最大 |
| W原子的第一至第六电离能分别为:I1=578KJ•mol-1,I2=1817KJ•mol-1,I3=2745KJ•mol-1,I4=11575KJ•mol-1,I5=14830KJ•mol-1,I6=18376KJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R原子最高能层上只有1个单电子,其余各能层均已充满电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原裂纹处有碳积存 | |
| B. | 裂纹处表面积很大,反应快 | |
| C. | 裂纹处的尘埃起催化作用 | |
| D. | 裂纹处有氧化铁积存,并与盐酸作用生成可溶性氯化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com