
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
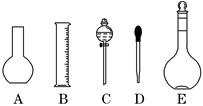
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
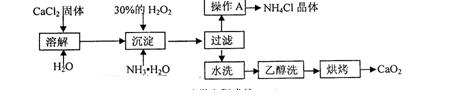
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
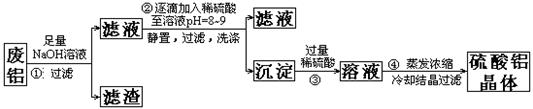
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
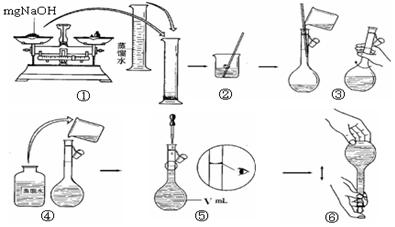
 确程序 。
确程序 。| A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸 馏水 馏水 |
| C.转移溶液后的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.称量时,直接把氢氧化钠放在纸上称量,且称量时间过长 |
| B.称量时,固体放在右盘,砝码放在左盘 |
| C.称量时所用砝码生锈 |
| D.原容量瓶用蒸馏水洗净后未干燥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.称取7.68gCuSO4固体,加入480mL水 | B.称取12.0g胆矾配制成480mL溶液 |
| C.称取8.0gCuSO4固体,加入500mL水 | D.称取12.5 g胆矾配制成500mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com