
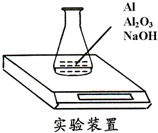
 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
分析 (1)称量至恒重是需要的数据,反应产生的氢气质量为188.30-188.24=0.06g
(2)样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为$\frac{0.54g}{2.58g}$×100%=20.9%.
解答 解:(1)称量至恒重是需要的数据,依据图表数据可知,称重恒重的质量为188.24g,所以反应产生的氢气质量为188.30-188.24=0.06g,故答案为:0.06;
(2)依据反应可知,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成氢气0.03mol,需要铝物质的量为0.02mol;
样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为$\frac{0.54g}{2.58g}$×100%=20.9%;
答:样品中Al的质量分数为$\frac{0.54g}{2.58g}$×100%=20.9%.
点评 本题考查了实验称重的原则分析和数据处理的分析应用,铝的性质应用,注意反应前后称重的数据是称量至恒重误差小,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C(Na+)>C(Ac-)=C(OH-)>C(H+) | B. | C(Na+)>C(Ac-)>C(OH-)>C(H+) | ||
| C. | C(Na+)=C(Ac-)+C(HAc) | D. | C(Na+)+C(H+)=C(Ac-)+C(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe | ||
| C. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | D. | KCl+Ag NO3═KNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com