
分析 (1)CaCO3不溶于水;
(2)碘不易溶于水,易溶于有机溶剂;
(3)自来水中水的沸点较低;
(4)植物油和水分层;
(5)硝酸钾的溶解度受温度影响大,但NaCl量多,可蒸发分离;
(6)KC1O3加热分解生成KCl.
解答 解:(1)CaCO3不溶于水,则过滤可除去Ca(OH)2溶液中悬浮的CaCO3,故答案为:B;
(2)碘不易溶于水,易溶于有机溶剂,则萃取法可分离出碘水中的碘,故答案为:C;
(3)自来水中水的沸点较低,则蒸馏法制取蒸馏水,故答案为:D;
(4)植物油和水分层,选择分液法分离,故答案为:A;
(5)硝酸钾的溶解度受温度影响大,但NaCl量多,可蒸发分离,即蒸发结晶法可除去杂质,故答案为:E;
(6)KC1O3加热分解生成KCl,则加热分解法可除杂,故答案为:F.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、分离方法选择为解答的关键,侧重分析与实验能力的考查,注意分离原理及方法的使用,题目难度不大.


 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验目的 |
| ①将贝壳煅烧后制成石灰乳. | |
| ②将海水进行浓缩. | |
| ③加入石灰乳沉淀过滤. | 沉淀镁离子生成氢氧化镁沉淀 |
| ④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤. | |
| ⑤将得到的产物干燥除水后,MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑(填化学方程式)得到金属镁. |
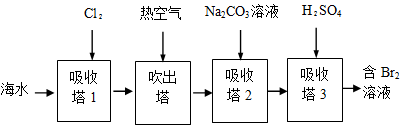
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1 mol•L-1盐酸和1L mol•L-1硫酸分别与1 L2 mol•L-1NaOH溶液反应速率相同 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1,其含义是时间为1s时,某物质的浓度是0.8mol•L-1 | |
| C. | 0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤ | C. | ③⑦ | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol/(L•s) | B. | 0.10 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 2.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Al3+含有的核外电子数为3NA | |
| B. | 将5.85 g NaCl溶于100g水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1 mol Cl2与足量的铁反应,转移的电子数为2NA | |
| D. | 常温下,pH=1的硫酸溶液中含有的H+数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com