
下列有关元素化合物的叙述中正确的是
A.钠在空气中燃烧生成白色的氧化钠固体
B.检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液
C.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色
D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:填空题
(12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验:

已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:计算题
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图10、图11分别是实验室模拟合成氨及氨催化氧化的装置
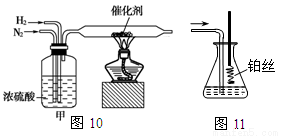
(1)氮气和氢气通过图10装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图11装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子
C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为 。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量约为20%)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列措施是为了降低化学反应速率的是
A.食品放在冰箱中贮藏
B.双氧水制氧气时加入少量二氧化锰
C.试管中进行镁和水反应时,稍微加热
D.铁粉代替铁钉与稀硫酸反应制取氢气
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:计算题
(10分)将54.4 g铁粉和氧化铁的混合物中加入200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:⑴.混合物铁和氧化铁各是多少克?⑵.原稀硫酸物质的量浓度?⑶.反应后得到FeSO4的物质的量是多少?
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在的较多的阳离子是
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(14分)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点FeO NiO (填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为 。

(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的强相互作用是 ;
(3)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。


①用A、B、O表示这类特殊晶体的化学式: 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。
③下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图所示
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
下列各组原子中,化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子
C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
用下列实验装置进行的相应实验,能达到实验目的的是
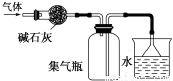
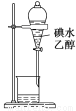
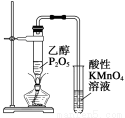
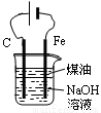
图1 图2 图3 图4
A.图1所示装置可干燥、收集氨气,并吸收多余的氨
B.图2所示装置可萃取碘水中的碘
C.图3所示装置可证明乙醇发生消去反应生成了乙烯
D.图4所示装置可制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com