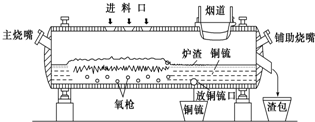
高富氧底吹熔池炼铜新工艺反应炉如图
(1)该新工艺的优点之一是混合矿料不需要干燥、磨细.烟气进入余热锅炉后,经静电除尘后进入酸厂回收利用,这样做体现化学的
思想.
(2)该新工艺的优点之二是首次投料需要添加少量的燃料,当反应充分启动后就不需要再投放燃料,说明反应炉中的反应总体来说是
反应.
(3)此法冶炼的矿石主要是黄铜矿(主要成分是CuFeS
2),经过上面设备煅烧后最终化合态的铜生成铜和SO
2,在冶炼铜矿过程中存在重要反应:2CuFeS
2+O
2=Cu
2S+2FeS+SO
2、2Cu
2S+3O
2=2Cu
2O+2SO
2、
.
(4)从放铜锍口放出的铜锍中还含有铁和硫必须除去,铜锍吹炼过程是火法冶炼生产粗铜的最后一道工序,吹炼过程分为两个阶段.第一阶段的任务是使铁氧化造渣,主要化学反应为:①2FeS+3O
2+SiO
2=2FeO?SiO
2+2SO
2,第二阶段是使上一个阶段中没有反应彻底的Cu
2S氧化成粗铜,主要化学反应为:②Cu
2S+O
2=2Cu+SO
2,下列关于反应①、②的分析正确的是
(填序号)
A.反应②氧化剂只有O
2B.硫元素在①和②均被氧化
C.①和②在反应过程中都有共价键破坏和共价键形成
(5)图中渣包中的炉渣含有Fe
2O
3、FeO、SiO
2等,选用提供的试剂设计实验验证炉渣中含有FeO.提供的试剂:KMnO
4溶液、KSCN溶液、NaOH溶液、稀硫酸、稀盐酸,所选试剂为
.实验现象是
.



 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O. 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3辣反应生成CO2. 请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3辣反应生成CO2. 请回答下列问题: 高富氧底吹熔池炼铜新工艺反应炉如图
高富氧底吹熔池炼铜新工艺反应炉如图