
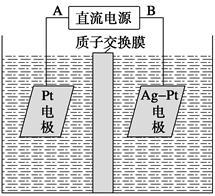
 (或其他合理答案)
(或其他合理答案)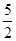 O2↑
O2↑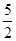 mol×32 g·mol-1+10 g=90 g
mol×32 g·mol-1+10 g=90 g =14.4 g。
=14.4 g。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源:不详 题型:单选题

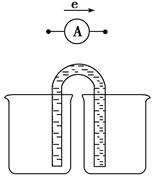
| A.X和Y不连接时,铜棒上会有金属银析出 |
| B.X和Y用导线连接时,银棒上发生的反应为Ag++e—=Ag |
| C.若X接直流电源的正极Y接负极,Ag+向银电极移动 |
| D.无论X和Y是否连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A的金属性强于B |
| B.A电极上发生的电极反应是还原反应 |
| C.电子不断由A电极经外电路流向B电极 |
| D.A在金属活动性顺序表中一定排在氢前面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
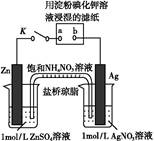
| A.Ag电极上发生氧化反应 |
B.盐桥中N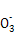 向Zn电极移动 向Zn电极移动 |
| C.电子沿Zn→a→b→Ag路径流动 |
| D.片刻后可观察到滤纸a点变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
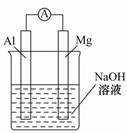
| A.Mg比Al活泼,Mg失去电子被氧化成Mg2+ |
| B.铝条表面虽有氧化膜,但可不必处理 |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
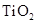 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: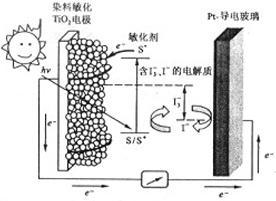
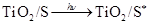 (激发态)
(激发态)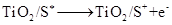
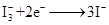
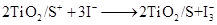
| A.电池工作时,是将太阳能转化为电能 |
| B.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| C.电池中镀铂导电玻璃为正极 |
| D.电池的电解质溶液中I-和I3-的浓度不会减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com