
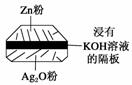
微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。下列叙述正确的是( )
A.在使用过程中,电解质KOH被不断消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.每转移2mol e-,有232gAg2O被氧化
D.Zn是负极,Ag2O是正极
科目:高中化学 来源: 题型:
下列反应中,水做还原剂的是( )
A.2F2+2H2O===4HF+O2 B.SO2+H2O===H2SO3
C.2Na+2H2O===2NaOH+H2↑ D.2H2+O2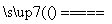 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定是碱性的是:( )
A.pH=8的某电解质的溶液 B.c(OH-)>1×10-7mol/L
C.溶液中含有OH- D.溶液中c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图曲线a表示反应X(g)+Y(g) +N(s)  Z(g)+M(g) △H<0进行过程中X的转化
Z(g)+M(g) △H<0进行过程中X的转化
率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进
行,可采取的措施是( )
A.升高温度 B.加大N的投入量
C.缩小体积 D.加大X的投入量

查看答案和解析>>
科目:高中化学 来源: 题型:
根据热化学方程式:S(s)+O2(g)=SO2(g)ΔH=akJ·mol—1,分析下列说法中错误的是( )
A.S(s)在O2(g)中燃烧是放热反应
B.S(g)+O2(g)=SO2(g)ΔH=bkJ·mol—1,则a<b
C.1mol SO2(g)所具有的能量低于1molS(s)与1molO2(g)所具有的能量和
D.16g固体硫在空气中充分燃烧,可放出—a/2kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,
两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=7 |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,判断HA是 (填“强酸”或“弱酸”)
某同学欲利用甲组中的一元酸HA溶液滴定未知浓度的NaOH溶液,可选取 作指示剂;在滴定过程中,下列哪些操作会使结果偏高的是
A.酸式滴定管未用标准酸HA润洗,直接装入标准酸HA
B.酸式滴定管滴定前有气泡,滴定后气泡消失
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
D.读取酸HA体积开始时仰视读数,滴定结束后俯视读数
E.锥形瓶用蒸馏水洗净后,再用待测NaOH溶液润洗
(2)根据乙组数据分析,乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。
某同学取丁组试剂各100mL,充分反应后测得放出的热量为Q,写出表示中和热的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同,且SO42-的物质的量浓度为6mol•L-1,则此溶液最多溶解铁粉的质量为
A.11.2g B.14.0g C.22.4g D.33.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com