
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
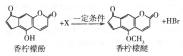 香柠檬油可用于化妆品生产.香柠檬油中含有微量的香柠檬酚和香柠檬醚,二者之间存在如下转化关系,下列说法错误的是( )
香柠檬油可用于化妆品生产.香柠檬油中含有微量的香柠檬酚和香柠檬醚,二者之间存在如下转化关系,下列说法错误的是( )| A. | 香柠檬酚和香柠檬醚均可与NaOH溶液反应 | |
| B. | 香柠檬酚使溴水、酸性KMnO4溶液褪色的原理相同 | |
| C. | X是CH3Br,相应的反应是取代反应 | |
| D. | 1mol香柠檬酚和1mol香柠檬醚分别完全燃烧时,后者耗氧量比前者多1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、明矾、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | 电解质是在水溶液或熔融状态下能导电的化合物 | |
| C. | 在含有1 mol Fe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| D. | 玻璃棒在化学实验中只起到搅拌的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下不导电的化合物都是非电解质 | |
| B. | 液氯是纯净物,氯水是混合物,均不属于电解质 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 硫酸溶于水可以导电,所以浓硫酸是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| B. | 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大 | |
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 | |
| D. | 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
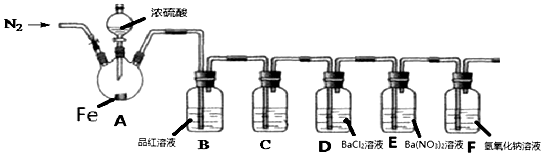
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
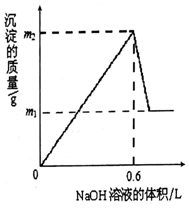 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH<7 | B. | 得到澄清透明溶液 | ||
| C. | 得到浑浊液 | D. | 先有白色沉淀生成,后逐渐溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com