

| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
分析 (1)根据量热计的构造来判断该装置的缺少仪器;根据金属棒是热的良导体,易传热,而且能与盐酸反应;
(2)通过量热器测定反应过程中所放出的热量可计算中和热;
(3)中和热测定实验成败的关键是保温工作;
(4)不盖硬纸板,会有一部分热量散失;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;根据物质的物质的量与热量之间的关系以及热化学方程式的书写方法书写;
(6)根据弱电解质电离吸热分析;
(7)根据少量盐酸在反应中挥发,反应的盐酸偏少,放出的热量偏小;
(8)先求出三次反应的温度差,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
解答 解:(1)根据量热计的构造来判断该装置的缺少仪器为环形玻璃搅拌棒;铁质搅拌棒的导热性好,易传热,散发热量,所得中和热的测定值比理论值偏低,而且铁会与盐酸反应;
故答案为:环形玻璃搅拌棒;不能;铁的导热系数大,容易散热;铁会与盐酸反应;
(2)图示中用品填加后的装置叫量热器,量热器能测定反应过程中所放出的热量从而计算中和热;
故答案为:量热器;
(3)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温,减少实验过程中的热量损失,
故答案为:保温,减少热量的散失;
(4)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(5)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关;在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:不相等;相等;NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)NH3•H2O为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,求得的中和热数值将会减小,
故答案为:偏小;
(7)少量盐酸在反应中挥发,盐酸挥发吸收热量,且盐酸偏少,放出的热量偏小,测得的中和热数值偏低;
故答案为:偏低;
(8)三次前后温度差分别为:6.6℃,6.7℃,6.8℃,均有效,平均值为$\frac{6.6℃+6.7℃+6.8℃}{3}$=6.7℃,50mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液的质量和为100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×100g×6.7℃=28.006KJ,即生成0.5mol的水放出热量28.006KJ,所以生成1mol的水放出热量为28.006KJ×2=56.01kJ,即该实验测得的中和热△H=-56.0kJ/mol;
故答案为:-56.0kJ/mol;
点评 本题考查热化学方程式以及反应热的计算,注意理解中和热的概念以及测定反应热的误差等问题,掌握实验原理即可解答,难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
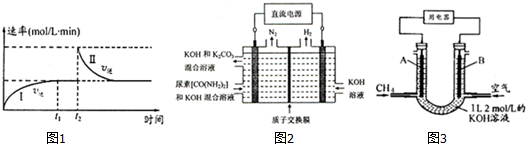
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,溶解 冷却、过滤, | 得到白色晶体和无色溶液 | -- |
| ② | 取少量滤液于试管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
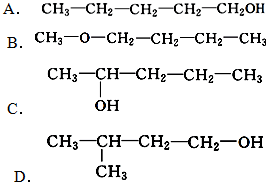
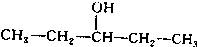 .
.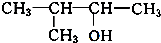 、
、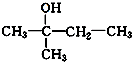 写出另外两种同分异构体的结构简式:
写出另外两种同分异构体的结构简式: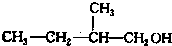 、
、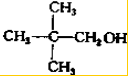 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com